Avastin
Avastin ngăn không cho VEGF gắn với các thụ thể của nó, Flt-1 và KDR, trên bề mặt tế bào nội mạc. Sự trung hòa hoạt tính sinh học của VEGF làm giảm sinh mạch của khối u, vì vậy ức chế sự tăng trưởng của khối u.
Biên tập viên: Trần Tiến Phong
Đánh giá: Trần Trà My, Trần Phương Phương
Nhà sản xuất
Roche.
Thành phần
Mỗi lọ: Bevacizumab (kháng thể đơn dòng kháng VEGF đã nhân hóa) 100mg hoặc 400mg.
Cơ chế tác dụng
Avastin (bevacizumab) là một kháng thể đơn dòng nhân hóa tái tổ hợp gắn chọn lọc với và trung hòa hoạt tính sinh học của yếu tố tăng trưởng nội mạc mạch máu người (VEGF). Bevacizumab gồm những vùng khung cấu trúc của người kết hợp những vùng gắn kháng nguyên của một kháng thể chuột nhân hóa gắn được với VEGF. Bevacizumab được sản xuất bởi kỹ thuật tái tổ hợp DNA trong hệ thống biểu hiện tế bào động vật hữu nhũ ở buồng trứng chuột lang Trung Quốc trong môi trường dinh dưỡng có chứa kháng sinh gentamicin và được tinh lọc bởi quá trình bao gồm bất hoạt vi rút đặc hiệu và nhiều bước loại bỏ. Chỉ có thể phát hiện gentamicin trong sản phẩm cuối cùng ở nồng độ ≤ 0,35 ppm. Bevacizumab gồm có 214 amino acid và trọng lượng phân tử khoảng 149.000 dalton.
Avastin ngăn không cho VEGF gắn với các thụ thể của nó, Flt-1 và KDR, trên bề mặt tế bào nội mạc. Sự trung hòa hoạt tính sinh học của VEGF làm giảm sinh mạch của khối u, vì vậy ức chế sự tăng trưởng của khối u. Sử dụng bevacizumab hoặc kháng thể chuột tiền thân của nó trên các mẫu ung thư dị ghép ở chuột trụi lông tạo ra hoạt tính kháng u mạnh trên những khối ung thư của người, bao gồm đại tràng, vú, tụyvà tiền liệt tuyến. Thuốc ngăn chặn diễn tiến bệnh di căn và làm giảm tính thấm vi mạch.
Dược lực học
Nhóm dược lý/điều trị: Thuốc kháng ung thư. Mã ATC: L01XC07.
Các nghiên cứu về Hiệu quả/Lâm sàng
Ung thư đại trực tràng di căn (mCRC): Người ta nghiên cứu hiệu quả và tính an toàn của liều Avastin khuyến cáo (5mg/kg cân nặng mỗi hai tuần) trên ung thư đại tràng hoặc trực tràng di căn trong ba thử nghiệm lâm sàng ngẫu nhiên, có kiểm chứng với hoạt chất, trong phối hợp với hóa trị bước một có fluoropyrimidine. Avastin được kết hợp với hai phác đồ hóa trị sau:
AVF2107g: Sử dụng irinotecan/5-fluorouracil/leucovorin tiêm nhanh mỗi tuần (phác đồ IFL) trong tổng cộng 4 tuần cho mỗi chu kỳ 6 tuần.
AVF0780g: Phối hợp với tiêm nhanh 5-fluorouracil/leucovorin (5-FU/LV) trong tổng cộng 6 tuần cho mỗi chu kỳ 8 tuần (phác đồ Roswell Park).
AVF2192g: Phối hợp với tiêm nhanh 5-fluorouracil/leucovorin (5-FU/LV) trong tổng cộng 6 tuần cho mỗi chu kỳ 8 tuần (phác đồ Roswell Park) trên những bệnh nhân không phải là đối tượng tối ưu để điều trị irinotecan bước một.
Ngoài ra còn có thêm hai nghiên cứu được tiến hành cho điều trị bước một (NO16966) và điều trị bước hai (E3200) trên ung thư đại tràng hoặc trực tràng di căn, trong đó Avastin được dùng phối hợp với FOLFOX-4 (5FU/LV/Oxaliplatin) và XELOX (Capecitabine/Oxaliplatin) theo những phác đồ như sau:
NO16966: Avastin 7,5mg/kg cân nặng, mỗi 3 tuần, phối hợp với capecitabine đường uống và oxaliplatin tiêm tĩnh mạch (XELOX); hoặc Avastin 5mg/kg cân nặng, mỗi 2 tuần, phối hợp với leucovorin và 5-fluorouracil tiêm nhanh, sau đó truyền 5-fluorouracil với oxaliplatin truyền tĩnh mạch (FOLFOX-4).
E3200: Avastin 10mg/kg cân nặng, mỗi 2 tuần, phối hợp với leucovorin và 5-fluorouracil tiêm nhanh, sau đó truyền 5-fluorouracil với oxaliplatin truyền tĩnh mạch (FOLFOX-4).
AVF2107g: Đây là thử nghiệm lâm sàng pha III, ngẫu nhiên, mù đôi, có nhóm chứng dùng hoạt chất, nhằm đánh giá phối hợp Avastin với IFL trong điều trị bước đầu cho ung thư đại tràng hoặc trực tràng di căn. 813 bệnh nhân được chia nhóm ngẫu nhiên cho sử dụng IFL + giả dược (Nhóm 1) hoặc IFL + Avastin (5mg/kg mỗi 2 tuần, Nhóm 2). Nhóm thứ ba có 110 bệnh nhân được tiêm nhanh 5-FU/LV + Avastin (nhóm 3). Nhóm 3 ngừng nhận bệnh, như đã xác định trước, một khi tính an toàn của phác đồ Avastin kèm IFL được xác lập và xem như có thể chấp nhận được.
Thông số về hiệu quả chính của thử nghiệm này là sống thêm toàn bộ. Sử dụng Avastin cùng với IFL làm tăng có ý nghĩa thống kê sống thêm toàn bộ, sống không bệnh tiến triển và tỷ lệ đáp ứng toàn bộ (xem bảng 1 để biết chi tiết). Lợi ích lâm sàng của Avastin, được đánh giá bằng thời gian sống thêm, được ghi nhận trên tất cả các phân nhóm bệnh nhân được xác định từ trước, bao gồm những nhóm được xác định bởi tuổi, giới tính, tình trạng hoạt động cơ thể, vị trí khối u nguyên phát, số cơ quan bị ảnh hưởng, và thời gian bệnh di căn.
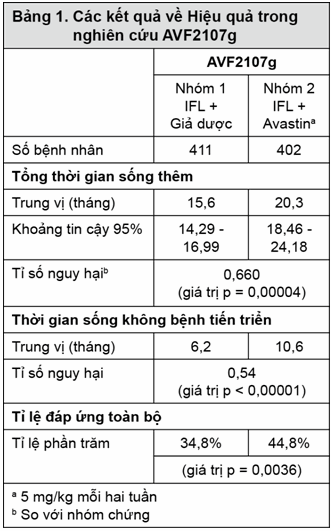
Trong số 110 bệnh nhân được chọn ngẫu nhiên vào Nhóm 3 (5-FU/LV + Avastin) trước khi ngừng nhận bệnh vào nhóm này, người ta thấy trung vị thời gian sống thêm toàn bộ là 18,3 tháng và trung vị thời gian sống không bệnh tiến triển là 8,8 tháng.
AVF2192g: Đây là thử nghiệm lâm sàng pha II ngẫu nhiên, mù đôi, có nhóm chứng dùng hoạt chất, nhằm nghiên cứu Avastin trong phối hợp với 5-FU/Leucovorin để điều trị bước một ung thư đại trực tràng di căn trên bệnh nhân không phải là đối tượng tối ưu cho điều trị irinotecan bước một. 105 bệnh nhân được chọn ngẫu nhiên vào nhóm 5-FU/LV + giả dược và 104 bệnh nhân được chọn ngẫu nhiên vào nhóm 5-FU/LV + Avastin (5mg/kg mỗi 2 tuần). Tất cả các điều trị được tiếp tục cho đến khi bệnh tiến triển.
Sử dụng phối hợp Avastin 5mg/kg mỗi hai tuần với 5-FU/LV cho tỉ lệ đáp ứng khách quan cao hơn, thời gian sống không bệnh tiến triển dài hơn đáng kể, và có xu hướng sống thêm lâu hơn, so với hóa trị 5-FU/LV đơn thuần.
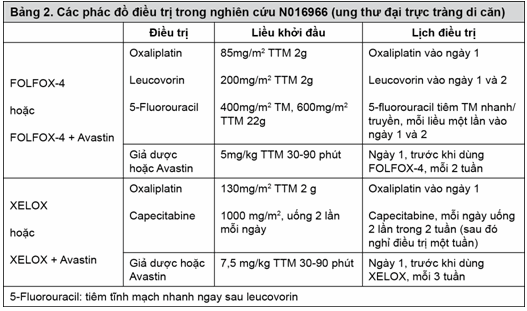
NO16966: Đây là thử nghiệm lâm sàng pha III ngẫu nhiên, mù đôi (cho bevacizumab), nhằm nghiên cứu Avastin 7,5mg/kg dùng phối hợp với capecitabine đường uống và oxaliplatin truyền tĩnh mạch (XELOX) trong một chu kỳ mỗi 3 tuần; hoặc Avastin 5mg/kg dùng phối hợp với leucovorin và 5-fluorouracil tiêm nhanh, sau đó truyền tĩnh mạch 5-fluorouracil cùng với oxaliplatin truyền tĩnh mạch (FOLFOX-4) trong một chu kỳ mỗi 2 tuần. Nghiên cứu này gồm hai phần: Phần I là phần ban đầu, không mù, hai nhóm, trong đó các bệnh nhân được chọn ngẫu nhiên vào hai nhóm trị liệu khác nhau là XELOX hoặc FOLFOX-4. Phần II là phần tiếp theo, có 4 nhóm theo thiết kế giai thừa 2x2, trong đó các bệnh nhân được chọn ngẫu nhiên vào bốn nhóm trị liệu khác nhau là XELOX + giả dược, FOLFOX-4 + giả dược, XELOX + Avastin và FOLFOX-4 + Avastin. Trong phần II này, chỉ định điều trị là mù đôi đối với Avastin.
Có khoảng 350 bệnh nhân được chọn ngẫu nhiên vào trong mỗi nhóm của bốn nhóm nghiên cứu trong phần II của thử nghiệm này.
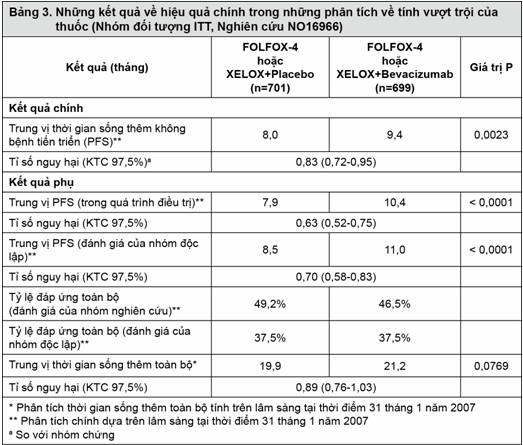
Thông số về hiệu quả chính của thử nghiệm này là thời gian sống không bệnh tiến triển. Trong nghiên cứu này, có hai mục đích chính là: chứng tỏ XELOX không kém hơn FOLFOX-4; và Avastin khi phối hợp với hóa trị FOLFOX-4 hoặc XELOX thì tốt hơn so với hóa trị đơn thuần. Cả hai mục đích chính này đều đã đạt được:
Sự không thua kém ở nhóm sử dụng XELOX và nhóm sử dụng FOLFOX-4 trong so sánh tổng thể đã được chứng minh qua số liệu về thời gian sống không bệnh tiến triển và sống thêm toàn bộ trong dân số theo phác đồ thỏa tiêu chí.
ii) Sự ưu thế của nhóm sử dụng Avastin so với nhóm chỉ dùng hóa trị đơn thuần trong so sánh tổng thể đã được chứng minh qua số liệu về thời gian sống không bệnh tiến triển trong dân số theo chủ định điều trị (ITT) (Bảng 3).
Những phân tích phụ về thời gian sống không bệnh tiến triển, dựa vào những đánh giá đáp ứng từ Ủy ban xem xét độc lập và 'trong quá trình điều trị', đã xác nhận rằng những bệnh nhân dùng Avastin đã đạt được những lợi ích cao đáng kể về mặt lâm sàng (những phân tích nhóm phụ được trình bày ở Bảng 3), điều này nhất quán với những lợi ích có ý nghĩa về mặt thống kê đã được quan sát thấy trong phân tích gộp chung.
ECOG E3200: Đây là một nghiên cứu pha III ngẫu nhiên, có nhóm chứng dùng hoạt chất, nhãn mở, nhằm đánh giá về liệu pháp Avastin 10mg/kg dùng phối hợp với leucovorin và 5-fluorouracil tiêm nhanh, sau đó truyền 5-fluorouracil cùng với oxaliplatin truyền tĩnh mạch (FOLFOX-4) trong chu kỳ mỗi 2 tuần ở những bệnh nhân ung thư đại trực tràng tiến triển đã được điều trị trước đó (bước hai). Trong những nhóm dùng hóa trị, FOLFOX-4 được dùng với cùng liều lượng và chu kỳ như đã được trình bày ở Bảng 3 của nghiên cứu NO16966.
Thông số về hiệu quả chính của thử nghiệm này là thời gian sống thêm toàn bộ, được định nghĩa là thời gian từ lúc được chọn ngẫu nhiên cho đến lúc tử vong do bất kỳ nguyên nhân nào. 829 bệnh nhân đã được chọn ngẫu nhiên cho thử nghiệm này, trong đó có 292 bệnh nhân được dùng FOLFOX-4, 293 bệnh nhân được dùng Avastin + FOLFOX-4 và 244 bệnh nhân được dùng Avastin đơn trị. Kết quả cho thấy dùng phối hợp Avastin với FOLFOX-4 kéo dài thời gian sống thêm có ý nghĩa về mặt thống kê. Đồng thời cũng ghi nhận được sự cải thiện có ý nghĩa về mặt thống kê của thời gian sống không bệnh tiến triển và tỷ lệ đáp ứng khách quan (xem Bảng 4).
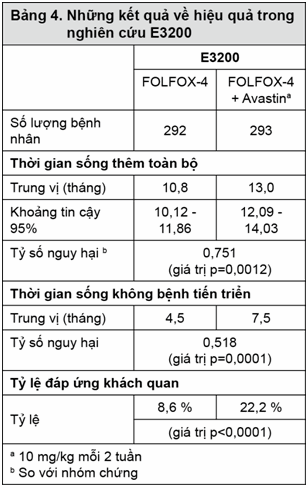
Không ghi nhận được sự khác biệt đáng kể về thời gian sống thêm toàn bộ giữa những bệnh nhân được dùng Avastin đơn trị với những bệnh nhân được điều trị FOLFOX-4. Thời gian sống thêm không bệnh tiến triển và tỷ lệ đáp ứng khách quan ở nhóm dùng Avastin đơn trị kém hơn so với nhóm dùng FOLFOX-4.
Ung thư phổi không phải tế bào nhỏ, tiến triển, tái phát hoặc di căn (UTPKTBN): Tính an toàn và hiệu quả của Avastin trong điều trị bước một cho những bệnh nhân ung thư phổi không phải tế bào nhỏ (UTPKTBN) và không có tế bào vảy chiếm phần lớn về mô học, đã được nghiên cứu kết hợp hóa trị có platin trong nghiên cứu E4599 và BO17704.
E4599 là một thử nghiệm lâm sàng đa trung tâm, nhãn mở, ngẫu nhiên, có nhóm chứng dùng hoạt chất, nhằm đánh giá việc sử dụng Avastin trong điều trị bước một cho những bệnh nhân UTPKTBN, không có tế bào vảy chiếm phần lớn về mô học, tiến triển tại chỗ, di căn hoặc tái phát. Bệnh nhân được chọn ngẫu nhiên để điều trị với hóa trị liệu có platin (truyền tĩnh mạch paclitaxel 200mg/m2 và carboplatin AUC=6,0) vào ngày 1 của chu kỳ mỗi 3 tuần, kéo dài đến 6 chu kỳ; hoặc điều trị như trên phối hợp với Avastin 15mg/kg truyền tĩnh mạch vào ngày 1 của chu kỳ mỗi 3 tuần. Sau khi hoàn tất 6 chu kỳ với hóa trị carboplatin-paclitaxel hoặc vào lúc phải ngưng sớm hóa trị liệu, bệnh nhân trong nhóm dùng Avastin+carboplatin-paclitaxel vẫn tiếp tục được dùng Avastin đơn trị mỗi 3 tuần cho đến khi bệnh tiến triển. Có 878 bệnh nhân đã được chọn ngẫu nhiên vào trong hai nhóm của thử nghiệm này.
Trong suốt quá trình nghiên cứu, trong số những bệnh nhân được điều trị theo phác đồ của thử nghiệm có 32,2% (136/422) bệnh nhân được dùng Avastin từ 7-12 lần và 21,1% (89/422) bệnh nhân được dùng Avastin từ 13 lần trở lên. Kết cuộc chính của thử nghiệm này là khoảng thời gian sống thêm. Kết quả được trình bày ở Bảng 5.
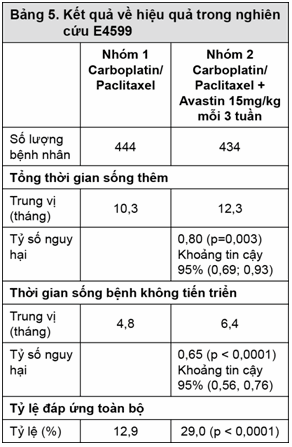
BO17704: Nghiên cứu BO17704 là một nghiên cứu pha III ngẫu nhiên, mù đôi so sánh giữa Avastin và giả dược khi dùng phối hợp với cisplatin và gemcitabin để điều trị cho những bệnh nhân NSCLC, không phải tế bào vảy, tiến triển tại chỗ, di căn hoặc tái phát mà chưa được hóa trị trước đó. Kết cuộc chính của nghiên cứu này là thời gian sống mà bệnh không tiến triển.
Bệnh nhân được điều trị ngẫu nhiên với hóa trị có platin là cisplatin 80mg/m2 truyền tĩnh mạch vào ngày 1 và gemcitabine 1250mg/m2 truyền tĩnh mạch vào ngày 1 và ngày 8 của chu kỳ mỗi 3 tuần, kéo dài đến 6 chu kỳ cùng với giả dược; hoặc cùng với Avastin 7,5mg hoặc 15mg/kg truyền tĩnh mạch vào ngày 1 của chu kỳ mỗi 3 tuần. Trong nhóm dùng Avastin, bệnh nhân có thể được dùng Avastin đơn trị mỗi 3 tuần cho đến khi bệnh tiến triển hoặc khi xuất hiện độc tính nguy hiểm. Những kết quả của nghiên cứu này cho thấy rằng 94% (277/298) những bệnh nhân thỏa mãn tiêu chí đã được tiếp tục dùng bevacizumab đơn trị cho đến chu kỳ thứ 7.
Kết quả về hiệu quả được trình bày ở Bảng 6.
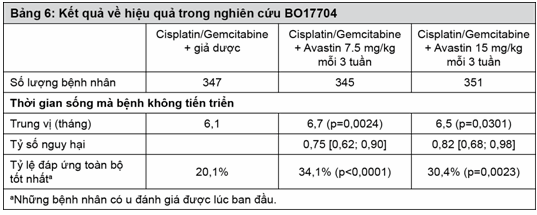
Ung thư tế bào thận tiến triển và/hoặc di căn (UTTBTdc): BO17705 là một thử nghiệm pha III ngẫu nhiên, đa trung tâm, mù đôi, được tiến hành để đánh giá tính hiệu quả và an toàn của Avastin khi phối hợp với interferon alfa 2a (Roferon) so với interferon alfa 2a đơn trị trong điều trị bước một cho những bệnh nhân ung thư tế bào thận tiến triển và/hoặc di căn. 649 bệnh nhân được chọn ngẫu nhiên (641 bệnh nhân được điều trị) trong thử nghiệm này đều bị UTTBTdc dạng tế bào sáng, tình trạng hoạt động theo Karnofsky (KPS) ≥ 70%, không có di căn đến hệ thần kinh trung ương và chức năng của thận chưa bị suy giảm. Interferon alfa 2a (x 3 lần mỗi tuần với liều khuyên dùng 9MIU) phối hợp Avastin (10mg/kg mỗi 2 tuần) hoặc giả dược đã được dùng cho đến khi bệnh tiến triển. Những bệnh nhân này lại được phân tầng theo quốc gia và theo thang điểm Motzer và người ta thấy rằng những nhóm được điều trị có sự cân bằng về những yếu tố tiên lượng.
Tại thời điểm dừng dữ liệu, có 505 biến cố đã xảy ra, 111 bệnh nhân vẫn được duy trì điều trị, 287 bệnh nhân được chấm dứt điều trị (ngưng điều trị trong thử nghiệm do biến cố bất lợi chiếm 12% ở nhóm dùng interferon so với 28% ở nhóm dùng interferon alfa 2a/Avastin) và 251 bệnh nhân tử vong. 97 bệnh nhân ở nhóm IFN alfa-2a và 131 bệnh nhân ở nhóm Avastin giảm liều IFN alfa-2a từ 9 MIU xuống 6MIU và 3MIU 3 lần mỗi tuần như qui định trong đề cương. Việc giảm liều IFN alfa-2a dường như không ảnh hưởng tới hiệu quả của kết hợp Avastin và IFN alfa-2a dựa trên tỷ lệ không có biến cố PFS qua các giai đoạn, được thể hiện qua phân tích các nhóm phụ. 131 bệnh nhân thuộc nhóm Avastin kết hợp IFN alfa-2a được giảm và duy trì với liều 3MIU hoặc 6MIU trong suốt thời gian nghiên cứu, kết quả cho thấy, tại các thời điểm 6, 12 và 18 tháng tỷ lệ không có biến cố PFS lần lượt là 73,52 và 21% so với 61,43 và 17% trong toàn bộ các bệnh nhân có kết hợp Avastin và IFN alfa-2a. Sử dụng Avastin phối hợp với interferon alfa 2a làm tăng đáng kể thời gian sống không bệnh tiến triển và tỷ lệ đáp ứng khách quan của khối u (xem Bảng 7). PFS và ORR được đánh giá bởi nhóm nghiên cứu được trình bày trong bảng 7. Kết quả này cũng đã được khẳng định bởi các chuyên gia đánh giá độc lập. Dữ liệu về thời gian sống thêm toàn bộ chưa hoàn chỉnh vào thời điểm của phân tích PFS cuối cùng này. Xu hướng cải thiện sống thêm toàn bộ được ghi nhận khi dùng phối hợp Avastin với interferon alfa 2a (p=0,0670).
AVF2938: Đây là thử nghiệm lâm sàng pha II ngẫu nhiên, mù đôi nhằm đánh giá Avastin 10mg/kg dùng trong chu kỳ mỗi 2 tuần so với cùng liều Avastin dùng phối hợp với erlotinib 150mg hàng ngày để điều trị bệnh nhân ung thư tế bào thận di căn dạng tế bào sáng. Tổng cộng có 104 bệnh nhân đã được chọn ngẫu nhiên để điều trị trong nghiên cứu này, 53 bệnh nhân được dùng Avastin 10mg/kg mỗi 2 tuần cùng với giả dược, 51 bệnh nhân được dùng Avastin 10mg/kg mỗi hai tuần cùng với erlotinib 150mg hàng ngày. Phân tích kết cuộc chính của thử nghiệm này cho thấy không có sự khác biệt giữa nhóm dùng Avastin + giả dược so với nhóm dùng Avastin + erlotinib (trung vị thời gian sống không bệnh tiến triển là 8,5 tháng so với 9,9 tháng). Có 7 bệnh nhân trong mỗi nhóm đã đạt được đáp ứng khách quan.
U nguyên bào thần kinh đệm và U tế bào thần kinh đệm ác tính:
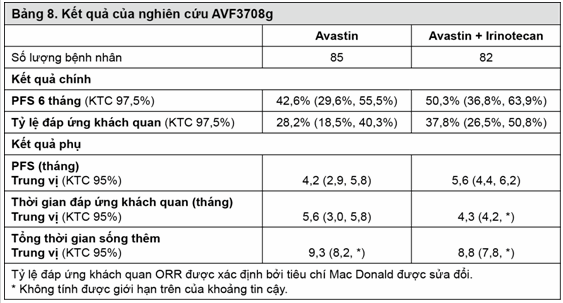
AVF3708g: Hiệu quả và tính an toàn của Avastin trong điều trị cho bệnh nhân u nguyên bào thần kinh đệm đã được nghiên cứu trong 1 nghiên cứu mở, đa trung tâm, ngẫu nhiên, không đối chứng (nghiên cứu AVF3708g).
Bệnh nhân u nguyên bào thần kinh đệm tái phát lần đầu hoặc lần hai sau khi được xạ trị trước đó (hoàn tất ít nhất 8 tuần trước khi điều trị với Avastin) và temozolomide, được chia ngẫu nhiên sử dụng Avastin (10mg/kg truyền tĩnh mạch mỗi 2 tuần) hoặc Avastin và irinotecan (125mg/m2 truyền tĩnh mạch hoặc 340 mg/m2 truyền tĩnh mạch trên bệnh nhân dùng thuốc chống động kinh gây cảm ứng men, mỗi 2 tuần) cho tới khi bệnh tiến triển hoặc không thể dung nạp do độc tính. Kết quả chính của nghiên cứu là đánh giá tỷ lệ sống thêm không bệnh tiến triển 6 tháng và tỷ lệ đáp ứng khách quan theo đánh giá của nhóm xem xét độc lập. Các kết quả khác là thời gian không bệnh tiến triển, thời gian đáp ứng và thời gian sống thêm toàn bộ.
Kết quả của nghiên cứu được tóm tắt trong bảng 8.
Ung thư biểu mô buồng trứng, ống dẫn trứng và ung thư phúc mạc nguyên phát:
Điều trị bước một ung thư buồng trứng: Tính an toàn và hiệu quả của Avastin trong điều trị bước một ở bệnh nhân ung thư biểu mô buồng trứng, ống dẫn trứng hoặc ung thư phúc mạc nguyên phát đã được nghiên cứu ở hai thử nghiệm lâm sàng pha III (GOG-0218 và BO17707) so sánh tác dụng của việc kết hợp Avastin với carboplatin và paclitaxel so với chỉ điều trị bằng hóa trị.
GOG-0218: GOG-0218 là một nghiên cứu đa trung tâm ngẫu nhiên, mù đôi, có kiểm chứng với giả dược, 3 nhánh nghiên cứu, nhằm đánh giá tác dụng của việc kết hợp Avastin với một chế độ hóa trị đã được chấp thuận (carboplatin và paclitaxel) ở bệnh nhân bị ung thư biểu mô buồng trứng, ống dẫn trứng và ung thư phúc mạc nguyên phát giai đoạn 3 hoặc 4 đã được phẫu thuật cắt bỏ một phần lớn khối u ác tính một cách tối ưu hoặc gần tối ưu.
Tổng cộng 1873 bệnh nhân được chọn ngẫu nhiên theo tỷ lệ bằng nhau cho ba nhánh sau đây:
Nhánh CPP: Giả được kết hợp với carboplatin (AUC 6) và paclitaxel (175 mg/m2) trong 6 chu kỳ, sau đó đơn trị liệu bằng giả dược, tổng thời gian điều trị lên tới 15 tháng.
Nhánh CPB15: 5 chu kỳ điều trị Avastin (15 mg/kg mỗi 3 tuần) kết hợp với carboplatin (AUC 6) và paclitaxel (175 mg/m2) trong 6 chu kỳ (bắt đầu dùng Avastin ở chu kỳ 2 của hóa trị liệu), sau đó đơn trị liệu bằng giả dược, tổng thời gian điều trị lên tới 15 tháng.
Nhánh CPB15+: 5 chu kỳ điều trị Avastin (15 mg/kg mỗi 3 tuần) kết hợp với carboplatin (AUC 6) và paclitaxel (175 mg/m2) trong 6 chu kỳ (bắt đầu dùng Avastin ở chu kỳ 2 của hóa trị liệu), sau đó tiếp tục dùng Avastin đơn trị (15 mg/kg mỗi 3 tuần) trong thời gian điều trị tổng cộng lên tới 15 tháng.
Kết cuộc chính là thời gian sống sót bệnh không tiến triển (PFS) dựa trên việc đánh giá các kết quả chụp X-quang của điều tra viên. Ngoài ra, các đánh giá độc lập về kết cuộc chính cũng được tiến hành.
Các kết quả của nghiên cứu này được tóm tắt trong Bảng 9.
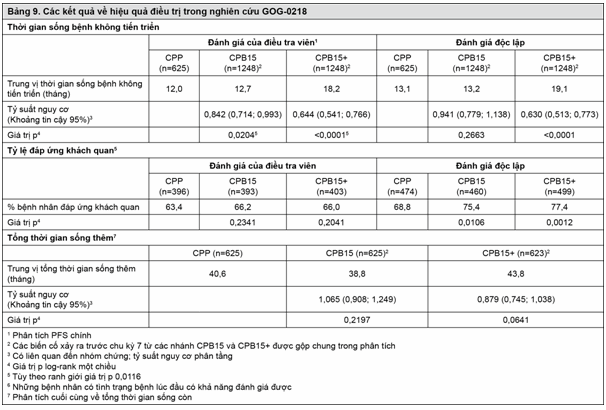
Thử nghiệm đáp ứng mục tiêu chính của nó là cải thiện PFS. So với bệnh nhân được điều trị bằng đơn hóa trị (carboplatin và paclitaxel), ở bệnh nhân đã được điều trị bước một bằng bevacizumab ở liều 15 mg/kg mỗi 3 tuần kết hợp với hóa trị và tiếp tục dùng bevacizumab đơn độc đã có một sự cải thiện có ý nghĩa trên lâm sàng và có ý nghĩa thống kê về PFS.
Mặc dù đã có sự cải thiện về PFS ở những bệnh nhân đã được điều trị bước một bằng bevacizumab kết hợp với hóa trị và đã không tiếp tục dùng bevacizumab đơn độc, sự cải thiện là không có ý nghĩa lâm sàng, cũng như không có ý nghĩa về mặt thống kê so với bệnh nhân đã đơn hóa trị.
BO17707 (ICON7): BO17707 là một nghiên cứu pha III, 2 nhánh, đa trung tâm, ngẫu nhiên, có kiểm chứng, nhãn mở so sánh với hiệu quả của việc kết hợp Avastin với carboplatin và paclitaxel ở bệnh nhân ung thư biểu mô buồng trứng, ống dẫn trứng hoặc ung thư phúc mạc nguyên phát FIGO giai đoạn I hoặc IIA (Giai đoạn 3 hoặc chỉ những mô tế bào ung thư rõ ràng), hoặc FIGO giai đoạn IIB - IV (tất cả các giai đoạn và tất cả các loại mô) sau phẫu thuật và ở bệnh nhân không có kế hoạch phẫu thuật trước khi bệnh tiến triển.
Tổng cộng 1528 bệnh nhân được chọn ngẫu nhiên theo tỷ lệ bằng nhau cho 2 nhánh sau:
Nhánh CP: Carboplatin (AUC 6) và paclitaxel (175 mg/m2) trong 6 liệu trình.
Nhánh CPB7,5+: Carboplatin (AUC 6) và paclitaxel (175 mg/m2) trong 6 liệu trình có thêm Avastin (7,5 mg/kg mỗi 3 tuần) lên tới 18 liệu trình.
Kết quả chính là thời gian sống còn mà bệnh không tiến triển (PFS) dựa trên việc đánh giá của điều tra viên.
Các kết quả của nghiên cứu này được tóm tắt trong Bảng 10.
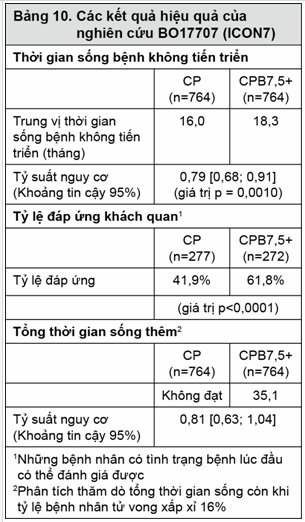
Thử nghiệm đáp ứng mục tiêu chính của nó là cải thiện PFS. So với bệnh nhân được điều trị bằng hóa trị đơn thuần (carboplatin và paclitaxel), ở bệnh nhân đã được điều trị bằng bevacizumab ở liều 7,5 mg/kg mỗi 3 tuần kết hợp với hóa trị và tiếp tục dùng bevacizumab cho tới 18 liệu trình đã có một sự cải thiện có ý nghĩa thống kê về PFS.
Ung thư buồng trứng tái phát
AVF4095g: Độ an toàn và hiệu quả của Avastin trong điều trị cho bệnh nhân ung thư buồng trứng, ống dẫn trứng tái phát hoặc ung thư phúc mạc nguyên phát nhạy cảm với platin chưa dùng hóa trị để ngăn tái phát trước đó hoặc trước đó chưa điều trị bằng bevacizumab đã được đánh giá trong một nghiên cứu lâm sàng pha III ngẫu nhiên, mù đôi, đối chứng placebo (AVF4095g). Nghiên cứu so sánh hiệu quả khi bổ sung Avastin vào phác đồ hóa trị liệu dùng carboplatin và gemcitabine và tiếp tục dùng Avastin đơn trị liệu tiến tới dùng carboplatin và gemcitabin đơn độc.
Tổng số có 484 bệnh nhân với mức độ bệnh đo lường được phân ngẫu nhiên thành 2 nhóm tương đương dùng một trong 2 phác đồ sau:
Carboplatin (AUC4, Ngày 1) và gemcitabin (1000 mg/m2 vào ngày 1 và 8) và đồng thời với placebo mỗi 3 tuần một lần trong 6 đến 10 liệu trình sau khi dùng placebo đơn độc cho đến khi bệnh tiến triển hoặc bệnh nhân không chịu được độc tính của thuốc.
Carboplatin (AUC4, Ngày 1) và gemcitabin (1000 mg/m2 vào Ngày 1 và 8) và đồng thời với Avastin (15 mg/kg Ngày 1) 3 tuần một lần trong 6 đến 10 liệu trình, tiếp theo dùng Avastin đơn độc (15 mg/kg mỗi 3 tuần) cho đến khi bệnh tiến triển hoặc bệnh nhân không chịu được độc tính của thuốc.
Chỉ tiêu đánh giá chủ yếu là thời gian sống bệnh không tiến triển dựa trên đánh giá của nghiên cứu viên sử dụng tiêu chí RECIST. Chỉ tiêu đánh giá bổ sung bao gồm đáp ứng mục tiêu, thời gian đáp ứng, độ an toàn và thời gian sống toàn bộ. Một đánh giá độc lập về các tiêu chí chính cũng được thực hiện.
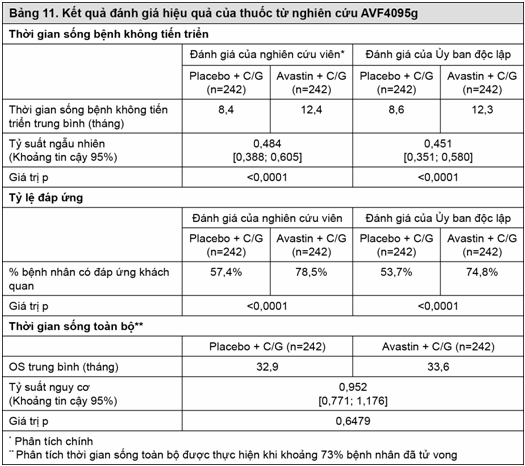
Kết quả của nghiên cứu này được tóm tắt trong Bảng 11.
MO22224 (AURELIA): Nghiên cứu MO22224 đánh giá hiệu quả và độ an toàn của bevacizumab kết hợp với hóa trị liệu để điều trị ung thư buồng trứng tái phát kháng platin. Thử nghiệm lâm sàng pha III ngẫu nhiên, nhãn mở bao gồm 2 nhóm được thiết kế để đánh giá bevacizumab kết hợp hóa trị liệu (CT+BV) so với hóa trị liệu đơn độc (CT).
Tổng số có 361 bệnh nhân tham gia vào nghiên cứu sử dụng hoặc hóa trị liệu đơn độc (paclitaxel, topotecan, hoặc PLD) hoặc kết hợp với bevacizumab:
Nhóm CT (hóa trị liệu đơn độc)
Paclitaxel 80 mg/m2 truyền tĩnh mạch trong 1 giờ vào ngày 1, 8, 15 và 22 bốn tuần một lần.
Topotecan 4 mg/m2 truyền tĩnh mạch trong 30 phút vào ngày 1, 8 và 15 bốn tuần một lần. Ngoài ra, có thể dùng liều 1,25 mg/m2 truyền trong vòng 30 phút vào ngày 1-5 ba tuần một lần.
PLD 40 mg/m2 truyền tĩnh mạch tốc độ 1 mg/phút vào Ngày 1 mỗi 4 tuần một lần. Sau liệu trình 1, thuốc có thể được truyền trong 1 giờ.
Nhóm dùng CT-BV (hóa trị liệu kết hợp với bevacizumab)
Hóa trị liệu được lựa chọn kết hợp với bevacizumab 10 mg/kg truyền tĩnh mạch hai tuần một lần (hoặc bevacizumab 15 mg/kg mỗi 3 tuần nếu dùng kết hợp với topotecan 1,25 mg/m2 vào Ngày 1-5 ba tuần một lần).
Bệnh nhân hội đủ điều kiện bị ung thư buồng trứng có bệnh tiến triển trong vòng 6 tháng đã điều trị bằng platin trước đây. Nếu bệnh nhân trước đây đã tham gia vào một thử nghiệm mù với một thuốc kháng tạo mạch bệnh nhân sẽ được xếp vào nhóm tương tự như bệnh nhân đã được dùng thuốc kháng tạo mạch trước đây.
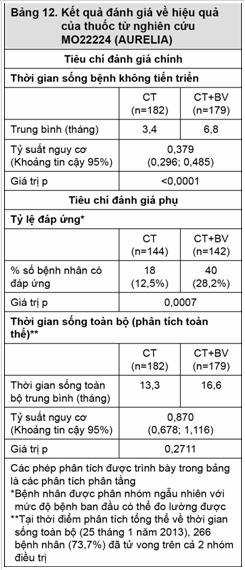
Tiêu chí đánh giá chính là thời gian sống bệnh không tiến triển, với tiêu chí đánh giá phụ bao gồm tỷ lệ đáp ứng và thời gian sống toàn bộ. Kết quả được trình bảy ở Bảng 12.
Ung thư cổ tử cung
GOG-0240
Hiệu quả và độ an toàn của bevacizumab khi kết hợp với hóa trị liệu (paclitaxel và cisplatin hoặc paclitaxel và topotecan) để điều trị cho bệnh nhân ung thư biểu mô cổ tử cung dai dẳng, tái phát hoặc di căn, được đánh giá trong nghiên cứu GOG-0240, thử nghiệm lâm sàng pha III ngẫu nhiên, đa trung tâm bao gồm 4 nhóm.
Tổng số 452 bệnh nhân được chia ngẫu nhiên thành 4 nhóm:
Paclitaxel 135 mg/m2 truyền tĩnh mạch trong 24 giờ vào Ngày 1 và cisplatin 50 mg/m2 truyền tĩnh mạch vào Ngày 2, mỗi 3 tuần (3 tuần một lần); hoặc paclitaxel 175 mg/m2 truyền tĩnh mạch trong 3 giờ vào Ngày 1 và cisplatin 50 mg/m2 truyền tĩnh mạch vào Ngày 2 (3 tuần một lần); hoặc paclitaxel 175 mg/m2truyền tĩnh mạch trong 3 giờ vào Ngày 1 và cisplatin 50 mg/m2 truyền tĩnh mạch vào Ngày 1 (3 tuần một lần).
Paclitaxel 135 mg/m2 truyền tĩnh mạch trong 24 giờ vào Ngày 1 và cisplatin 50 mg/m2 truyền tĩnh mạch vào Ngày 2 kết hợp với bevacizumab 15 mg/kg truyền tĩnh mạch vào Ngày 2 (3 tuần một lần); hoặc paclitaxel 175 mg/m2 IV trong 3 giờ vào Ngày 2 và cisplatin 50 mg/m2 IV vào Ngày 2 kết hợp với bevacizumab 15 mg/kg IV vào Ngày 2 (3 tuần một lần); hoặc paclitaxel 175 mg/m2 IV trong 3 giờ vào Ngày 1 và cisplatin 50 mg/m2 IV vào Ngày 1 và bevacizumab 15 mg/kg IV vào Ngày 1 (3 tuần một lần).
Paclitaxel 175 mg/m2 trong 3 giờ vào Ngày 1 và topotecan 0,75 mg/m2 trong 30 phút vào Ngày 1-3 (3 tuần một lần).
Paclitaxel 175 mg/m2 trong 3 giờ vào Ngày 1 và topotecan 0,75 mg/m2 trong 30 phút vào Ngày 1-3 kết hợp với bevacizumab 15 mg/kg IV vào Ngày 1 (3 tuần một lần).
Bệnh nhân hội đủ các điều kiện bị ung thư biểu mô tế bào vẩy dai dẳng, tái phát hoặc di căn, ung thư biểu mô tuyến vảy hoặc ung thư tế bào tuyến cổ tử cung không điều trị được bằng phẫu thuật và/hoặc xạ trị.
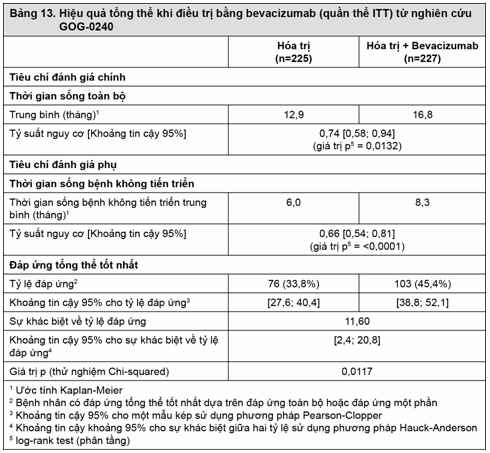
Tiêu chí đánh giá hiệu quả chủ yếu là thời gian sống toàn bộ (OS). Tiêu chí đánh giá hiệu quả phụ bao gồm thời gian sống bệnh không tiến triển (PFS) và tỷ lệ đáp ứng (ORR). Kết quả được trình bày ở Bảng 13.
Dược động học
Dược động học của bevacizumab được mô tả trên những bệnh nhân có các loại khối u đặc khác nhau. Những liều được thử nghiệm là 0,1-10mg/kg mỗi tuần trong nghiên cứu pha I; 3-20mg/kg mỗi 2 tuần hoặc mỗi 3 tuần trong nghiên cứu pha II; 5mg/kg (mỗi 2 tuần) hoặc 15mg/kg mỗi 3 tuần trong nghiên cứu pha III. Trong tất cả các thử nghiệm lâm sàng, bevacizumab được sử dụng theo đường truyền tĩnh mạch.
Như đã được ghi nhận ở các kháng thể khác, dược động học của bevacizumab được biểu thị rõ qua mô hình kiểu hai khoang. Nhìn chung, trong tất cả các thử nghiệm lâm sàng, bevacizumab có đặc điểm là có độ thanh thải thấp, thể tích giới hạn ở khoang trung tâm (Vc) và thời gian bán thải dài. Điều này giúp cho nồng độ của bevacizumab trong huyết tương ở mức đạt mục tiêu điều trị có thể được duy trì trong các loại chu kỳ điều trị (ví dụ như dùng một lần mỗi 2 tuần hoặc dùng một lần mỗi 3 tuần).
Trong phân tích dược động học theo quần thể, không có sự khác biệt đáng kể về dược động học của bevacizumab liên quan đến tuổi tác (không có sự tương quan giữa độ thanh thải bevacizumab và độ tuổi của đối tượng nghiên cứu [trung vị của độ tuổi là 59, với bách phân vị thứ 5 và thứ 95 của độ tuổi là 37 đến 76 tuổi]).
Nồng độ albumin thấp và phosphatase kiềm cao nhìn chung biểu thị độ nặng của bệnh và tổng khối u. Độ thanh thải Bevacizumab cao hơn khoảng 20% ở những đối tượng hoặc có nồng độ albumin huyết thanh thấp hoặc có nồng độ phosphatase kiềm cao, khi so sánh với những đối tượng điển hình có giá trị albumin và/hoặc phosphatase kiềm trung bình.
Phân bố: Giá trị điển hình của thể tích khoang trung tâm (VC) lần lượt là 2,66L và 3,25L trên đối tượng nữ và nam, giá trị này nằm trong phạm vi đã được xác định cho IgG và các kháng thể đơn dòng khác. Sau khi điều chỉnh theo trọng lượng cơ thể, những đối tượng nam giới có VC lớn hơn (+22%) những đối tượng nữ giới.
Chuyển hóa: Đánh giá chuyển hóa bevacizumab ở thỏ sau một liều truyền tĩnh mạch 125I-bevacizumab đã cho thấy đường biểu diễn chuyển hóa của nó cũng tương tự như đường biểu diễn có thể xảy ra với một phân tử IgG tự nhiên không gắn VEGF.
Đào thải: Dược động học của bevacizumab là một đường tuyến tính theo sự biến thiên của liều dùng từ 1,5 đến 10mg/kg/tuần.
Về trung bình, độ thanh thải bevacizumab là 0,207L/ngày đối với nữ và 0,262L/ngày đối với nam. Sau khi điều chỉnh theo trọng lượng cơ thể, đối tượng nam giới có độ thanh thải bevacizumab cao hơn (+ 26%) đối tượng nữ giới. Theo mô hình kiểu hai khoang thời gian bán hủy đầu (α) là 1,4 ngày cho cả hai giới; và thời gian bán hủy cuối (β) ước chừng là 20 ngày cho đối tượng nữ điển hình và 19 ngày cho đối tượng nam điển hình.
Dược động học ở các đối tượng đặc biệt: Dược động học của các đối tượng nghiên cứu đã được phân tích để đánh giá tác động của các đặc tính dân số học. Kết quả cho thấy không có sự khác biệt đáng kể về dược động học của bevacizumab liên quan tới lứa tuổi.
Trẻ em và vị thành niên: Dược động học của bevacizumab được nghiên cứu trên một số lượng bệnh nhi hạn chế. Các kết quả thu được cho thấy sự phân bố và thải trừ của bevacizumab tương đương với người trưởng thành có khối u đặc.
Suy thận: Chưa có nghiên cứu nào được tiến hành để tìm hiểu về dược động học của bevacizumab trên bệnh nhân suy thận do thận không phải là cơ quan chính tham gia vào chuyển hóa và thải trừ bevacizumab.
Suy gan: Chưa có nghiên cứu nào dược tiến hành để tìm hiểu về dược động học của bevacizumab trên bệnh nhân suy gan do gan không phải là cơ quan chính tham gia vào chuyển hóa và thải trừ bevacizumab.
An toàn tiền lâm sàng
Tính sinh ung thư: Chưa tiến hành các nghiên cứu để đánh giá khả năng gây ung thư của Avastin.
Tính gây đột biến: Chưa tiến hành các nghiên cứu để đánh giá khả năng gây đột biến của Avastin.
Tính gây suy giảm khả năng sinh sản: Chưa có nghiên cứu đặc hiệu tiến hành trên động vật để đánh giá tác động của Avastin lên khả năng sinh sản. Không ghi nhận tác động bất lợi trên cơ quan sinh sản của con đực trong các nghiên cứu độc tính liều nhắc lại trên khỉ cynomolgus.
Ức chế chức năng buồng trứng được đặc trưng bởi giảm trọng lượng buồng trứng và/hoặc tử cung và giảm số lượng hoàng thể, giảm tăng sinh nội mạc tử cung và ức chế sự trưởng thành của nang trứng trên khỉ cynomolgus được điều trị với Avastin trong 13 hoặc 26 tuần. Liều dẫn tới tác động này ≥ 4 lần liều điều trị cho người hoặc ≥ 2 lần độ phơi nhiễm có thể đạt được trên người tính theo nồng độ huyết thanh trung bình trên khỉ cái. Trên thỏ, sử dụng 50mg/kg Avastin làm giảm đáng kể trọng lượng buồng trứng và số lượng hoàng thể. Những hậu quả này trên cả khỉ và thỏ đều hồi phục được sau khi ngừng điều trị. Ức chế sinh mạch sau khi sử dụng Avastin có thể tác động bất lợi lên khả năng sinh sản của nữ.
Tính gây quái thai: Avastin có thể gây độc cho phôi và gây quái thai khi được dùng ở thỏ. Những tác động ghi nhận được bao gồm làm giảm trọng lượng của cả mẹ lẫn bào thai, tăng số lượng tiêu thai và tăng tỷ lệ những biến đổi về cấu trúc xương cũng như đại thể của bào thai. Những tác động bất lợi trên bào thai được quan sát thấy ở tất cả các liều thử nghiệm từ 10mg/kg đến 100mg/kg.
Tính an toàn tiền lâm sàng khác
Phát triển sụn tăng trưởng: Trong các nghiên cứu trong thời gian lên tới 26 tuần trên khỉ cynomolgus, Avastin gây loạn sản sụn tăng trưởng. Loạn sản sụn tăng trưởng đặc trưng chủ yếu bởi sụn đĩa tăng trưởng dày đặc, hình thành đĩa xương dưới lớp sụn và ức chế xâm nhập mạch máu vào các đĩa sụn tăng trưởng. Tác động này xảy ra tại liều ≥ 0,8 lần liều điều trị trên người và độ phơi nhiễm hơi thấp hơn độ phơi nhiễm lâm sàng có thể xảy ra trên người, dựa trên nồng độ huyết thanh trung bình. Tuy nhiên, cũng nên ghi nhận loạn sản sụn tăng trưởng chỉ xảy ra trên những động vật đang tăng trưởng nhanh với các đĩa sụn tăng trưởng mở. Vì Avastin có lẽ phần lớn được sử dụng trên bệnh nhân trưởng thành với các đĩa sụn đã đóng, loạn sản sụn tăng trưởng không có khả năng xảy ra trên nhóm bệnh nhân này.
Quá trình lành vết thương: Người ta đã nghiên cứu trên thỏ về tác động của Avastin lên quá trình lành vết thương dạng vòng. Quá trình tái biểu mô hóa vết thương bị chậm lại trên thỏ sau khi sử dụng 5 liều Avastin, trong khoảng từ 2-50mg/kg, trong thời gian hai tuần. Ghi nhận khuynh hướng có liên quan phụ thuộc liều. Mức độ tác động trên quá trình lành vết thương tương đương tác động ghi nhận được với sử dụng corticosteroid. Sau khi ngừng điều trị Avastin với liều hoặc 2mg/kg hoặc 10mg/kg, vết thương kín miệng hoàn toàn. Liều thấp 2mg/kg cũng gần tương đương với liều đề nghị trên lâm sàng. Một mô hình thử nghiệm trên quá trình lành vết thương thẳng có độ nhạy cao hơn cũng được nghiên cứu trên thỏ. Ba liều Avastin từ 0,5-2 mg/kg làm giảm sức căng của vết thương một cách đáng kể và phụ thuộc liều, nhất quán với sự làm chậm quá trình lành vết thương. Liều thấp 0,5mg/kg thấp hơn liều đề nghị trên lâm sàng 5 lần.
Vì tác động lên quá trình lành vết thương được ghi nhận trên thỏ với liều thấp hơn liều đề nghị trên lâm sàng, nên xem xét khả năng Avastin tác động bất lợi lên quá trình lành vết thương trên người.
Trên khỉ cynomolgus, các tác động của Avastin lên quá trình lành vết rạch thẳng rất thay đổi và không có quan hệ phụ thuộc liều rõ ràng.
Chức năng thận: Trên khỉ cynomolgus bình thường, Avastin không có tác động đáng kể lên chức năng thận khi được điều trị một lần hoặc hai lần một tuần trong thời gian lên tới 26 tuần, và không thấy tích lũy trong thận thỏ sau hai liều lên tới 100mg/kg (gấp khoảng 80 lần liều đề nghị trên lâm sàng).
Các nghiên cứu khảo sát độc tính trên thỏ, sử dụng các mô hình rối loạn chức năng thận, cho thấy Avastin không làm nặng thêm tổn thương ở cầu thận gây ra do albumin huyết thanh bò hoặc tổn thương ống thận gây ra do cisplatin.
Albumin: Trên khỉ cynomolgus đực, sử dụng Avastin với liều 10mg/kg hai lần mỗi tuần hoặc 50mg/kg một lần mỗi tuần trong 26 tuần đã làm giảm lượng albumin, giảm tỉ lệ albumin trên globulin và tăng globulin có ý nghĩa thống kê. Những tác động này có thể hồi phục sau khi ngưng phơi nhiễm. Vì các thông số vẫn còn ở trong phạm vi các giá trị tham khảo bình thường, những thay đổi này không được xem là có ý nghĩa trên lâm sàng.
Tăng huyết áp: Với liều lên tới 50mg/kg hai lần một tuần trên khỉ cynomolgus, Avastin cho thấy không có tác động lên huyết áp.
Sự cầm máu: Các nghiên cứu về độc tính phi lâm sàng trong thời gian 26 tuần trên khỉ cynomolgus không phát hiện biến đổi trên thông số đông máu hoặc huyết học bao gồm số lượng tiểu cầu, thời gian prothrombin (TP) và thời gian hoạt hóa một phần thromboplastin (TPA). Trong mẫu thử nghiệm về cầm máu trên thỏ, được sử dụng để nghiên cứu tác động của Avastin lên sự hình thành huyết khối, đã không cho thấy có thay đổi của tốc độ hình thành cục máu đông hoặc bất cứ thông số huyết học nào khác so với mẫu được điều trị với Avastin.
Chỉ định/Công dụng
Ung thư đại-trực tràng di căn (mCRC): Avastin, phối hợp với phác đồ hóa trị có fluoropyrimidine, được chỉ định trong điều trị cho bệnh nhân ung thư đại tràng hoặc trực tràng di căn.
Ung thư phổi không phải tế bào nhỏ, không vảy, tiến triển, di căn hoặc tái phát (NSCLC): Avastin, bổ sung vào phác đồ hóa trị có platin, được chỉ định trong điều trị bước một cho bệnh nhân ung thư phổi không phải tế bào nhỏ, không vảy, tiến triển không phẫu thuật được, di căn hoặc tái phát.
Ung thư tế bào thận tiến triển và/hoặc di căn (mRCC): Avastin, phối hợp với interferon alfa-2a được chỉ định trong điều trị bước một cho bệnh nhân ung thư tế bào thận tiến triển và/hoặc di căn.
U nguyên bào thần kinh đệm - U tế bào thần kinh đệm ác tính (Giai đoạn IV-WHO): Avastin, đơn trị liệu hoặc phối hợp với irinotecan, được chỉ định trong điều trị bệnh nhân u nguyên bào thần kinh đệm tái phát.
Ung thư biểu mô buồng trứng, ống dẫn trứng và ung thư phúc mạc nguyên phát:
Avastin kết hợp với carboplatin và paclitaxel được chỉ định đầu tay cho bệnh nhân người lớn mắc ung thư biểu mô buồng trứng, ống dẫn trứng và ung thư phúc mạc nguyên phát tiến xa (giai đoạn IIIB, IIIC và IV theo phân loại của Liên đoàn Sản phụ khoa thế giới - FIGO).
Avastin kết hợp với carboplatin và gemcitabin được chỉ định điều trị cho bệnh nhân người lớn có tái phát lần đầu của khối u biểu mô buồng trứng, ống dẫn trứng và ung thư phúc mạc nguyên phát nhạy cảm với platin trước đó chưa được điều trị bằng bevacizumab hay các thuốc ức chế VEGF hoặc thuốc tác động lên thụ thể của VEGF khác.
Avastin kết hợp với paclitaxel, topotecan hoặc doxorubicin liposom pegylat hóa được chỉ định điều trị cho bệnh nhân ung thư biểu mô buồng trứng, ống dẫn trứng tái phát, kháng platin hoặc ung thư phúc mạc nguyên phát đã được điều trị không quá hai phác đồ hóa trị liệu trước đó.
Ung thư cổ tử cung: Avastin kết hợp với paclitaxel và cisplatin hoặc paclitaxel và topotecan được chỉ định điều trị cho bệnh nhân ung thư biểu mô cổ tử cung dai dẳng, tái phát hoặc di căn.
Liều lượng & Cách dùng
Nguyên tắc chung
Avastin nên được chuẩn bị bởi nhân viên y tế sử dụng kỹ thuật vô khuẩn (xem phần Các hướng dẫn đặc biệt trong sử dụng, thao tác và thải bỏ thuốc).
Liều khởi đầu Avastin nên được truyền tĩnh mạch trong vòng 90 phút. Nếu lần truyền đầu dung nạp tốt, lần truyền lần thứ hai có thể truyền trong 60 phút. Nếu lần truyền trong 60 phút được dung nạp tốt, những lần truyền tiếp theo có thể truyền trong vòng 30 phút.
Không nên giảm liều Avastin khi xảy ra các biến cố bất lợi. Nếu có yêu cầu, hoặc ngừng hẳn hoặc tạm ngưng Avastin theo như hướng dẫn ở phần Cảnh báo.
Ung thư đại trực tràng di căn (UTĐTTdc)
Liều khuyên dùng của Avastin theo đường truyền tĩnh mạch như sau:
Điều trị bước một: 5mg/kg cân nặng, một lần mỗi 2 tuần; hoặc 7,5mg/kg cân nặng, một lần mỗi 3 tuần.
Điều trị bước hai: 10mg/kg cân nặng, một lần mỗi 2 tuần; hoặc 15mg/kg cân nặng, một lần mỗi 3 tuần.
Nên tiếp tục điều trị Avastin cho đến khi bệnh tiến triển.
Ung thư phổi không phải tế bào nhỏ, tiến triển, di căn hoặc tái phát (UTPKTBN)
Avastin được dùng để bổ sung vào phác đồ hóa trị có platin trong 6 chu kỳ điều trị, sau đó dùng Avastin đơn trị cho đến khi bệnh tiến triển.
Liều khuyên dùng của Avastin để bổ sung cho phác đồ hóa trị có cisplatin là 7,5mg/kg cân nặng, truyền tĩnh mạch một lần mỗi 3 tuần.
Liều khuyên dùng của Avastin để bổ sung cho phác đồ hóa trị có carboplatin là 15mg/kg cân nặng, truyền tĩnh mạch một lần mỗi 3 tuần.
Ung thư tế bào thận tiến triển và/hoặc di căn (UTTBTdc)
Liều khuyên dùng của Avastin theo đường truyền tĩnh mạch là 10mg/kg cân nặng, một lần mỗi 2 tuần.
U nguyên bào thần kinh đệm - U tế bào thần kinh đệm ác tính (Giai đoạn IV-WHO)
Liều khuyên dùng là truyền tĩnh mạch 10mg/kg cân nặng một lần mỗi 2 tuần hoặc 15mg/kg cân nặng một lần mỗi 3 tuần.
Nên tiếp tục điều trị Avastin cho đến khi bệnh tiến triển.
Ung thư biểu mô buồng trứng, ống dẫn trứng và ung thư phúc mạc nguyên phát
Liều Avastin được khuyến cáo dùng theo đường truyền tĩnh mạch như sau:
Điều trị đầu tay: 15 mg/kg cân nặng dùng một lần mỗi 3 tuần kết hợp với carboplatin và paclitaxel trong 6 liệu trình điều trị, tiếp theo tiếp tục dùng Avastin đơn trị liệu trong 15 tháng hoặc cho đến khi bệnh tiến triển tùy trường hợp nào xảy ra trước.
Điều trị bệnh tái phát
Nhạy cảm với platin: 15 mg/kg cân nặng dùng một lần mỗi 3 tuần kết hợp với carboplatin và gemcitabin từ 6 đến 10 liệu trình, tiếp theo dùng Avastin đơn trị liệu cho đến khi bệnh tiến triển.
Kháng platin: 10 mg/kg cân nặng một lần mỗi hai tuần kết hợp với một trong các thuốc sau: paclitaxel, topotecan (dùng hàng tuần) hoặc doxorubicin liposom pegylat hóa (xem Dược lực học - Các nghiên cứu về Hiệu quả/Lâm sàng - nghiên cứu MO22224 cho hóa trị liệu).
Có thể dùng 15 mg/kg mỗi 3 tuần khi kết hợp với topotecan vào ngày 1-5, mỗi 3 tuần (xem Dược lực học - Các nghiên cứu về Hiệu quả/Lâm sàng - nghiên cứu MO22224 cho hóa trị liệu).
Khuyến cáo tiếp tục điều trị cho đến khi bệnh tiến triển.
Ung thư cổ tử cung
Avastin được dùng kết hợp với một trong các thuốc sau trong phác đồ hóa trị liệu: paclitaxel và cisplatin hoặc paclitaxel và topotecan (xem Dược lực học - Các nghiên cứu về Hiệu quả/Lâm sàng - nghiên cứu GOG-0240 để biết thêm thông tin về phác đồ hóa trị liệu).
Liều được khuyến cáo của Avastin là 15 mg/kg cân nặng dùng một lần mỗi 3 tuần theo đường truyền tĩnh mạch.
Khuyến cáo tiếp tục điều trị Avastin cho đến khi bệnh tiến triển hoặc xuất hiện độc tính không dung nạp được.
Các hướng dẫn sử dụng liều đặc biệt
Trẻ em và thanh thiếu niên: Tính an toàn và hiệu quả của Avastin trên trẻ em và thanh thiếu niên chưa được nghiên cứu.
Người già: Không cần phải điều chỉnh liều dùng cho người già.
Suy thận: Tính an toàn và hiệu quả của Avastin chưa được nghiên cứu trên bệnh nhân suy thận.
Suy gan: Tính an toàn và hiệu quả của Avastin chưa được nghiên cứu trên bệnh nhân suy gan.
Các hướng dẫn đặc biệt trong Sử dụng, Thao tác và Thải bỏ thuốc
Dịch truyền Avastin không được truyền cùng hoặc pha lẫn với dung dịch dextrose hoặc dung dịch glucose (xem phần Tương kỵ)
Không được tiêm tĩnh mạch nhanh.
Avastin nên được nhân viên y tế chuẩn bị với kỹ thuật vô khuẩn. Rút lượng bevacizumab cần thiết và pha loãng trong một thể tích cần dùng dung dịch chloride natri 0,9%. Nồng độ dung dịch bevacizumab cuối cùng nên nằm trong khoảng từ 1,4 đến 16,5mg/mL.
Bỏ phần thuốc còn lại trong lọ, vì sản phẩm không có chất bảo quản. Các sản phẩm thuốc sử dụng đường tiêm truyền đều nên được kiểm tra bằng mắt thường xem có cặn và đổi màu hay không trước khi sử dụng.
Cảnh báo
Để cải thiện khả năng truy nguyên nguồn gốc của các sản phẩm thuốc sinh học, tên thương mại và số lô của các sản phẩm nên được lưu lại rõ ràng (hoặc ghi chú) trong hồ sơ bệnh án.
Thủng đường tiêu hóa: Bệnh nhân có thể tăng nguy cơ thủng đường tiêu hóa (xem phần Các thử nghiệm lâm sàng [Tác dụng ngoại ý]) và thủng túi mật (xem phần Tác dụng ngoại ý, Sau khi thuốc lưu hành trên thị trường) khi được điều trị Avastin. Nên ngừng hẳn Avastin trên những bệnh nhân bị thủng đường tiêu hóa.
Đường rò (xem thêm phần Các thử nghiệm lâm sàng [Tác dụng ngoại ý]): Bệnh nhân có thể bị tăng nguy cơ xuất hiện đường rò khi được điều trị Avastin (xem phần Các thử nghiệm lâm sàng [Tác dụng ngoại ý]).
Nên ngừng hẳn Avastin trên những bệnh nhân bị rò khí-thực quản hoặc bất kỳ đường rò độ 4 nào. Có rất ít thông tin về việc tiếp tục dùng Avastin cho những bệnh nhân bị các đường rò khác. Trong trường hợp đường rò nội tạng không xuất phát từ đường tiêu hóa, nên ngưng dùng Avastin.
Xuất huyết (xem thêm phần Các thử nghiệm lâm sàng [Tác dụng ngoại ý]): Bệnh nhân được điều trị với Avastin sẽ tăng nguy cơ bị xuất huyết, đặc biệt là xuất huyết liên quan khối u (xem phần Tác dụng ngoại ý: Kinh nghiệm từ các thử nghiệm lâm sàng - Xuất huyết). Nên ngưng hẳn Avastin trên bệnh nhân có chảy máu độ 3 hoặc 4 trong quá trình điều trị với Avastin.
Những bệnh nhân có tình trạng di căn hệ thần kinh trung ương không được điều trị thường bị loại khỏi các thử nghiệm lâm sàng với Avastin, dựa trên chẩn đoán hình ảnh hoặc các dấu hiệu và các triệu chứng. Vì vậy, nguy cơ xuất huyết não ở những bệnh nhân này không được đánh giá tiền cứu trong các nghiên cứu lâm sàng ngẫu nhiên (xem phần Tác dụng ngoại ý: Kinh nghiệm từ các thử nghiệm lâm sàng- Xuất huyết).
Bệnh nhân cần được theo dõi các dấu hiệu và triệu chứng của xuất huyết thần kinh trung ương và nên dừng điều trị Avastin nếu có xuất huyết nội sọ.
Không có thông tin về tính an toàn của Avastin trên những bệnh nhân có cơ địa dễ chảy máu bẩm sinh, bệnh đông máu mắc phải hoặc trên những bệnh nhân đang sử dụng đủ liều thuốc chống đông để điều trị thuyên tắc huyết khối trước khi khởi trị Avastin, vì những bệnh nhân như vậy đã bị loại khỏi các thử nghiệm lâm sàng. Vì vậy, nên thận trọng trước khi bắt đầu điều trị Avastin ở những bệnh nhân này. Tuy nhiên, những bệnh nhân bị huyết khối tĩnh mạch trong khi điều trị với Avastin không bị tăng tỉ lệ xuất huyết độ 3 hoặc cao hơn độ 3 khi điều trị đủ liều warfarin phối hợp với Avastin.
Nhiễm trùng mắt nghiêm trọng sau khi sử dụng qua đường tiêm nội nhãn là chỉ định chưa được chấp thuận (xem phần Tác dụng ngoại ý - Sau khi thuốc lưu hành trên thị trường): Các trường hợp riêng lẻ và nhóm các biến cố bất lợi đã được báo cáo (bao gồm viêm nội nhãn nhiễm trùng và những tình trạng viêm các bộ phận khác của mắt) sau khi tiêm vào nội nhãn, là đường dùng chưa được chấp thuận, hỗn hợp Avastin từ lọ dùng cho truyền tĩnh mạch ở bệnh nhân ung thư. Một số các biến cố đã dẫn đến mất thị trường ở các mức độ khác nhau, bao gồm mù vĩnh viễn.
Xuất huyết phổi/Ho ra máu (xem phần Tác dụng ngoại ý): Những bệnh nhân ung thư phổi không phải tế bào nhỏ được điều trị với Avastin có thể có nguy cơ bị xuất huyết phổi/ho ra máu nghiêm trọng, và một số trường hợp đã tử vong (xem phần Xuất huyết). Không nên dùng Avastin cho những bệnh nhân vừa mới bị xuất huyết phổi/ho ra máu (> 1/2 thìa cà-phê máu tươi).
Tăng huyết áp: Ghi nhận tăng tỉ lệ tăng huyết áp trên bệnh nhân được điều trị với Avastin. Các dữ liệu an toàn lâm sàng gợi ý tỉ lệ tăng huyết áp có thể phụ thuộc vào liều. Tăng huyết áp đã có từ trước phải được kiểm soát đầy đủ trước khi bắt đầu điều trị với Avastin. Không có thông tin về tác động của Avastin trên bệnh nhân tăng huyết áp không được kiểm soát lúc bắt đầu điều trị Avastin. Nên theo dõi huyết áp trong suốt quá trình điều trị với Avastin (xem thêm phần Các thử nghiệm lâm sàng [Tác dụng ngoại ý]).
Trong phần lớn các trường hợp, tăng huyết áp đều có thể được kiểm soát thỏa đáng bằng cách dùng thuốc hạ huyết áp thông thường một cách phù hợp cho từng bệnh nhân. Nếu tăng huyết áp nặng không thể kiểm soát được với các thuốc hạ huyết áp; hoặc nếu bệnh nhân lên cơn tăng huyết áp hoặc bị bệnh não do tăng huyết áp, nên ngưng sử dụng Avastin (xem phần Kinh nghiệm từ các thử nghiệm lâm sàngvà Kinh nghiệm sau khi thuốc lưu hành trên thị trường).
Hội chứng bệnh lý chất trắng não sau có thể hồi phục được (RPLS): Đã có một số trường hợp hiếm gặp những bệnh nhân đang được điều trị với Avastin bị các dấu hiệu và triệu chứng phù hợp với hội chứng bệnh lý chất trắng não sau có thể hồi phục được (RPLS). Đây là một rối loạn thần kinh hiếm gặp, thể hiện bằng các dấu hiệu và triệu chứng sau: co giật, đau đầu, trạng thái tâm thần thay đổi, rối loạn thị giác, hoặc mù vỏ não, có hoặc không kèm cao huyết áp. Cần phải có hình ảnh não để xác định chẩn đoán RPLS. Đối với những bệnh nhân bị RPLS, việc điều trị các triệu chứng đặc hiệu bao gồm kiểm soát huyết áp được khuyến cáo cùng với việc ngừng Avastin. Tính an toàn của việc tái điều trị Avastin ở những bệnh nhân đã bị RPLS chưa được biết (xem phần Kinh nghiệm sau khi thuốc lưu hành trên thị trường).
Thuyên tắc huyết khối động mạch: Trong những thử nghiệm lâm sàng, tỉ lệ biến cố thuyên tắc huyết khối động mạch bao gồm tai biến mạch máu não, cơn thoáng thiếu máu não (TIA) và nhồi máu cơ tim (NMCT) trên những bệnh nhân sử dụng Avastin phối hợp với hóa trị cao so với những bệnh nhân sử dụng hóa trị đơn thuần.
Nên ngưng Avastin vĩnh viễn ở những bệnh nhân bị biến cố thuyên tắc huyết khối động mạch.
Bệnh nhân sử dụng Avastin phối hợp với hóa trị có tiền sử bị thuyên tắc huyết khối động mạch hoặc tuổi trên 65 sẽ tăng nguy cơ bị biến cố thuyên tắc huyết khối động mạch trong quá trình điều trị với Avastin. Nên thận trọng khi điều trị Avastin trên những bệnh nhân này.
Thuyên tắc huyết khối tĩnh mạch (xem phần Tác dụng ngoại ý): Bệnh nhân có nguy cơ bị biến cố thuyên tắc huyết khối tĩnh mạch kể cả thuyên tắc phổi trong quá trình điều trị với Avastin. Nên ngưng Avastin ở những bệnh nhân bị thuyên tắc phổi nặng dọa tử vong (độ 4). Những bệnh nhân bị độ 3 trở xuống cần phải được theo dõi kỹ.
Suy tim sung huyết (xem phần Tác dụng ngoại ý): Những biến cố phù hợp với suy tim sung huyết đã được báo cáo trong các thử nghiệm lâm sàng. Những triệu chứng thay đổi từ giảm phân suất tống máu thất trái không có triệu chứng đến suy tim sung huyết có triệu chứng, cần phải được điều trị hoặc nhập viện.
Cần thận trọng khi điều trị bằng Avastin ở những bệnh nhân có bệnh tim mạch có biểu hiện lâm sàng như bệnh mạch vành từ trước hoặc suy tim sung huyết.
Phần lớn bệnh nhân bị suy tim sung huyết đều có ung thư vú di căn và được điều trị trước đó với anthracyclines, được xạ trị thành ngực trái trước đó hoặc có những yếu tố nguy cơ dễ bị suy tim sung huyết khác.
Ở những bệnh nhân trong nghiên cứu AVF3694g được điều trị lần đầu với anthracyclines, sự gia tăng xuất độ suy tim sung huyết ở mọi mức độ không được ghi nhận ở nhóm điều trị anthracyclines phối hợp bevacizumab so với nhóm chỉ sử dụng anthracyclines. Trong cả 2 nghiên cứu AVF3694g và AVF3693g, các biến cố suy tim sung huyết độ 3 hoặc nặng hơn có phần thường xảy ra ở nhóm bệnh nhân điều trị bevacizumab phối hợp với hóa trị hơn so với nhóm bệnh nhân chỉ điều trị bằng hóa trị. Các kết quả này nhất quán với kết quả ở bệnh nhân ung thư vú di căn không được điều trị đồng thời với anthracyclines trong các nghiên cứu khác (xem phần Kinh nghiệm từ các thử nghiệm lâm sàng [Tác dụng ngoại ý]).
Giảm bạch cầu trung tính: So với những bệnh nhân chỉ dùng hóa trị liệu đơn thuần, người ta thấy có sự tăng tỷ lệ giảm bạch cầu trung tính nặng, sốt giảm bạch cầu trung tính hoặc nhiễm trùng có giảm bạch cầu trung tính nặng (kể cả một vài trường hợp tử vong) ở những bệnh nhân được điều trị với một số phác đồ hóa chất gây độc cho tủy cùng với Avastin so với hóa trị đơn thuần.
Quá trình lành vết thương: Avastin có thể có tác động ngoại ý trên quá trình lành vết thương. Biến chứng nặng trong quá trình lành vết thương dẫn đến tử vong đã được báo cáo. Nên chờ ít nhất 28 ngày sau khi đại phẫu hoặc cho đến khi vết thương phẫu thuật đã lành hoàn toàn mới bắt đầu điều trị Avastin. Đối với bệnh nhân có biến chứng trong quá trình lành vết thương khi điều trị Avastin, nên ngưng sử dụng Avastin cho đến khi vết thương lành hoàn toàn. Liệu pháp Avastin nên được dừng để thực hiện mổ chương trình (xem phần Các thử nghiệm lâm sàng [Tác dụng ngoại ý]).
Việc cân mạc hoại tử bao gồm cả các trường hợp tử vong, hiếm khi được báo cáo ở các bệnh nhân được điều trị với Avastin; thường thứ phát sau các biến chứng trong việc lành vết thương, thủng hoặc tạo đường dò đường tiêu hóa. Cần ngưng điều trị Avastin ở các bệnh nhân bị viêm cân cơ hoại tử và các trị liệu thích hợp phải được tiến hành ngay lập tức (xem phần Tác dụng ngoại ý - Sau khi thuốc lưu hành trên thị trường).
Đạm niệu (xem phần Tác dụng ngoại ý): Trong những thử nghiệm lâm sàng, tỷ lệ xuất hiện đạm niệu ở những bệnh nhân dùng Avastin phối hợp với hóa trị liệu cao hơn so với những bệnh nhân chỉ dùng hóa trị liệu đơn thuần. Đạm niệu độ 4 (hội chứng thận hư) ít gặp ở những bệnh nhân dùng Avastin. Nên ngừng Avastin trên bệnh nhân bị đạm niệu độ 4.
Những phản ứng quá mẫn, phản ứng khi truyền (xem phần Tác dụng ngoại ý - Những thử nghiệm lâm sàng và sau khi thuốc lưu hành trên thị trường): Bệnh nhân có thể có nguy cơ xuất hiện phản ứng khi truyền/phản ứng quá mẫn. Quan sát kỹ bệnh nhân trong và sau khi tiêm truyền bevacizumab được khuyến cáo, như khi tiêm truyền bất kì một kháng thể đơn dòng nhân hóa nào khác. Nếu xảy ra phản ứng, việc truyền thuốc nên được dừng lại và sử dụng các biện pháp hỗ trợ phù hợp. Việc dùng thuốc phòng ngừa một cách hệ thống là không cần thiết.
Hoại tử xương hàm (ONJ): Các trường hợp hoại tử xương hàm ở những bệnh nhân ung thư được điều trị bằng Avastin đã được báo cáo, phần lớn trong số đó đã được điều trị trước đó hoặc phối trị với các thuốc bisphosphonate truyền tĩnh mạch, mà hoại tử xương hàm là một nguy cơ đã được xác định. Cần thận trọng khi dùng đồng thời hoặc tuần tự Avastin và bisphosphonate truyền tĩnh mạch. Thủ thuật nha khoa can thiệp cũng là một yếu tố nguy cơ được xác định. Nên khám nha khoa và dự phòng nha khoa phù hợp trước khi bắt đầu điều trị với Avastin. Ở những bệnh nhân trước đó hoặc đang được truyền tĩnh mạch bisphosphonate, nên tránh can thiệp thủ thuật nha khoa nếu có thể.
Dùng trong dịch kính: Avastin không được bào chế để sử dụng cho tiêm vào trong dịch kính.
Rối loạn về thị giác: Các trường hợp riêng lẻ và nhóm các biến cố bất lợi nghiêm trọng ở mắt đã được báo cáo sau khi tiêm vào trong dịch kính, là đường dùng không được chấp thuận với hỗn hợp Avastin từ lọ dùng cho truyền tĩnh mạch ở bệnh nhân ung thư. Những phản ứng này bao gồm nhiễm trùng nội nhãn, viêm nội nhãn cầu như viêm nội nhãn vô trùng, viêm màng bồ đào và viêm dịch kính, bong võng mạc, rách biểu mô sắc tố võng mạc, tăng nhãn áp, xuất huyết nội nhãn như xuất huyết dịch kính hoặc xuất huyết võng mạc và xuất huyết kết mạc. Một số các biến cố đã dẫn đến mất thị trường ở các mức độ khác nhau, bao gồm mù vĩnh viễn.
Các tác dụng ngoại ý toàn thân sau khi dùng trong dịch kính: Giảm nồng độ VEGF trong máu đã được chứng minh sau khi điều trị kháng VEGF qua đường tiêm nội nhãn. Các tác dụng ngoại ý toàn thân bao gồm cả xuất huyết ngoài mắt và các phản ứng huyết khối động mạch đã được báo cáo sau khi tiêm vào dịch kính các chất ức chế VEGF.
Suy giảm chức năng buồng trứng/khả năng sinh sản (xem phần Sử dụng ở những đối tượng đặc biệt,Phụ nữ có thai và Tác dụng ngoại ý - Các thử nghiệm lâm sàng): Avastin có thể làm suy giảm khả năng sinh sản ở nữ. Vì vậy chiến lược bảo tồn chức năng sinh sản nên được thảo luận với những phụ nữ ở độ tuổi sinh đẻ trước khi bắt đầu điều trị Avastin.
Tác động lên khả năng lái xe và vận hành máy móc: Chưa tiến hành nghiên cứu về tác động của thuốc lên khả năng lái xe và vận hành máy móc. Tuy nhiên, không có bằng chứng về việc điều trị Avastin làm tăng biến cố bất lợi có thể dẫn đến giảm khả năng lái xe và vận hành máy móc hoặc suy giảm khả năng trí tuệ.
Sử dụng ở trẻ em: Tính an toàn và hiệu quả của Avastin trên trẻ em và thanh thiếu niên vẫn chưa được nghiên cứu.
Avastin không được chấp thuận trong việc sử dụng cho bệnh nhân dưới 18 tuổi. Trong các báo cáo đã công bố, đã ghi nhận các trường hợp hoại tử xương tại những vị trí ngoài xương hàm ở các bệnh nhân dưới 18 tuổi phơi nhiễm với Avastin (xem phần An toàn tiền lâm sàng, Khác (Phát triển sụn tăng trưởng)).
Sử dụng ở người già: Tham khảo phần Cảnh báo ở mục Thuyên tắc huyết khối động mạch.
Bệnh nhân suy thận: Tính an toàn và hiệu quả của Avastin trên bệnh nhân bị suy thận vẫn chưa được nghiên cứu.
Bệnh nhân suy gan: Tính an toàn và hiệu quả của Avastin trên bệnh nhân bị suy gan vẫn chưa được nghiên cứu.
Quá liều
Liều cao nhất được thử nghiệm trên người (20mg/kg cân nặng, tiêm tĩnh mạch mỗi 2 tuần) có liên quan đến tình trạng đau nửa đầu nặng trên một vài bệnh nhân.
Chống chỉ định
Chống chỉ định Avastin trên bệnh nhân được biết là quá mẫn cảm với:
Bất kỳ thành phần nào của thuốc
Những sản phẩm làm từ tế bào buồng trứng chuột lang Trung Quốc hoặc các kháng thể người tái tổ hợp hay các kháng thể nhân hóa khác.
Chống chỉ định Avastin trên bệnh nhân có di căn đến hệ thần kinh trung ương chưa được điều trị (xem phần Cảnh báo và phần Các thử nghiệm lâm sàng [Tác dụng ngoại ý]).
Phụ nữ có thai.
Sử dụng ở phụ nữ có thai và cho con bú
Phụ nữ có thai: Sự sinh mạch được biết là có vai trò rất quan trọng cho sự phát triển của bào thai. Ức chế sinh mạch do sử dụng Avastin có thể gây hậu quả xấu trong thai sản.
Không có nghiên cứu kiểm chứng tốt và đầy đủ trên phụ nữ có thai (xem phần Tính gây quái thai). Người ta biết rằng IgG qua được hàng rào nhau thai, và Avastin có thể ức chế sự sinh mạch ở bào thai. Vì vậy, không nên sử dụng Avastin trong quá trình mang thai. Những phụ nữ có khả năng mang thai nên áp dụng các biện pháp tránh thai thích hợp trong quá trình điều trị Avastin. Dựa trên tính toán về dược động học, nên tiếp tục dùng các biện pháp tránh thai trong ít nhất 6 tháng kể từ khi sử dụng liều Avastin cuối cùng.
Khả năng sinh sản (xem phần Cảnh báo và Tác dụng ngoại ý từ các thử nghiệm lâm sàng): Các nghiên cứu về an toàn khi sử dụng liều lặp lại ở động vật đã chỉ ra rằng bevacizumab có thể có ảnh hưởng đến khả năng sinh sản của cá thể cái (xem phần An toàn tiền lâm sàng). Một nghiên cứu nhánh với 295 phụ nữ tiền mãn kinh cho thấy tỉ lệ các trường hợp suy giảm chức năng buồng trứng mới mắc cao hơn ở nhóm bevacizumab so với nhóm chứng. Sau khi ngưng điều trị bevacizumab, chức năng buồng trứng đã phục hồi ở phần lớn bệnh nhân. Ảnh hưởng lâu dài của điều trị bevacizumab lên chức năng sinh sản là chưa rõ.
Bà mẹ đang cho con bú: Không biết liệu bevacizumab có tiết qua sữa mẹ hay không. Vì IgG của mẹ được tiết qua sữa mẹ và Avastin có thể gây hại cho sinh trưởng và phát triển của trẻ, nên khuyên phụ nữ ngưng cho con bú trong khi điều trị Avastin và không cho con bú trong ít nhất 6 tháng kể từ liều Avastin cuối cùng.
Tương tác
Tác động của thuốc chống ung thư lên dược động học của bevacizumab: Dựa trên những kết quả phân tích dược động học dân số, người ta thấy không có tương tác dược động học liên quan đến lâm sàng khi dùng đồng thời hóa trị liệu với Avastin.
Không có sự khác biệt có ý nghĩa thống kê cũng như lâm sàng về độ thanh thải của Avastin ở những bệnh nhân sử dụng Avastin đơn trị so với những bệnh nhân phối hợp Avastin với interferon alpha-2a hoặc các liệu pháp hóa trị khác (IFL, 5-FU/LV, carboplatin/paclitaxel, capecitabine, doxorubicin hoặc cisplatin/gemcitabine).
Tác động của bevacizumab lên dược động học của những thuốc chống ung thư khác: Những kết quả từ nghiên cứu AVF3135g về tương tác thuốc-thuốc, cho thấy bevacizumab không có tác động đáng kể lên dược động học của irinotecan và chất chuyển hóa có hoạt tính của nó là SN38.
Những kết quả từ nghiên cứu NP18587 cho thấy bevacizumab không có tác động đáng kể lên dược động học của capecitabine và các chất chuyển hóa của nó; cũng như lên dược động học của oxaliplatin, và điều này đã được xác định qua giá trị platin tự do và platin toàn phần.
Những kết quả từ nghiên cứu B017705 cho thấy bevacizumab không có tác động đáng kể lên dược động học của interferon alfa-2a.
Những kết quả từ nghiên cứu BO17704 cho thấy bevacizumab không có tác động đáng kể lên dược động học của cisplatin.
Do có sự biến thiên giữa các bệnh nhân và hạn chế của cỡ mẫu thử nghiệm, những kết quả từ nghiên cứu BO17704 không cho phép kết luận chắc chắn về ảnh hưởng của bevacizumab lên dược động học của gemcitabine.
Phối hợp giữa bevacizumab với sunitinib malate: Trong hai nghiên cứu lâm sàng trên bệnh nhân ung thư thận đã ghi nhận 7 trong số 19 bệnh nhân có xuất hiện thiếu máu huyết tán bệnh lý vi mạch (microangiopathic hemolytic anemia viết tắt là MAHA) khi điều trị kết hợp bevacizumab (10mg/kg cân nặng mỗi 2 tuần) với sunitinib malate (50mg mỗi ngày).
MAHA là hiện tượng huyết tán có biểu hiện là hồng cầu bị vỡ, thiếu máu và giảm tiểu cầu. Thêm vào đó, một số những bệnh nhân này còn có các biểu hiện tăng huyết áp (bao gồm cả cơn tăng huyết áp), tăng creatinine và các triệu chứng của hệ thần kinh. Tất cả các triệu chứng trên cải thiện khi ngưng sử dụng bevacizumab và sunitinib malate (xem thêm phần Tăng huyết áp, Protein niệu, RPLS trong phần Cảnh báo).
Xạ trị: An toàn và hiệu quả khi điều trị đồng thời hóa trị (temozolomide), xạ trị và Avastin đã được đánh giá trong nghiên cứu BO21990, một nghiên cứu pha III, ngẫu nhiên, mù đôi, có đối chứng giả dược trên 921 bệnh nhân vừa được chẩn đoán u nguyên bào đệm thần kinh. Không biến cố bất lợi mới liên quan đến Avastin được ghi nhận trong nghiên cứu trên.
Tính an toàn và hiệu quả khi phối hợp xạ trị với Avastin vẫn chưa được xác lập.
Tương kỵ
Chưa ghi nhận tính không tương thích giữa Avastin và polyvinyl chloride hoặc túi polyolefin. Ghi nhận tình trạng thoái biến phụ thuộc nồng độ của Avastin khi pha loãng Avastin với dung dịch dextrose 5%.
Tác dụng ngoại ý
Kinh nghiệm từ các thử nghiệm lâm sàng
Những thử nghiệm lâm sàng đã được tiến hành trên những bệnh nhân bị nhiều loại khối u ác tính khác nhau được điều trị với Avastin, phần lớn là phối hợp với hóa trị. Những dữ liệu về tính an toàn của Avastin được lấy từ các thử nghiệm lâm sàng gồm hơn 5000 bệnh nhân được trình bày trong phần này. Về kinh nghiệm sau khi thuốc ra thị trường, xin xem phần Kinh nghiệm sau khi thuốc lưu hành trên thị trường bên dưới. Về chi tiết của những nghiên cứu chủ chốt, bao gồm đề cương và những kết quả về hiệu quả chính của nghiên cứu, xin xem phần Những nghiên cứu về hiệu quả/lâm sàng.
Những phản ứng có hại nghiêm trọng nhất của thuốc
Thủng đường tiêu hóa (xem phần Cảnh báo).
Xuất huyết kể cả xuất huyết phổi/ho ra máu, thường xảy ra ở những bệnh nhân ung thư phổi không phải tế bào nhỏ (UTPKTBN) (xem phần Cảnh báo)..
Thuyên tắc huyết khối động mạch (xem phần Cảnh báo)..
Các phân tích dữ liệu an toàn trên lâm sàng gợi ý rằng tăng huyết áp và protein niệu xảy ra khi điều trị với Avastin có thể phụ thuộc liều.
Các phản ứng có hại của thuốc thường được ghi nhận nhất trong tất cả các thử nghiệm lâm sàng trên bệnh nhân sử dụng Avastin là: tăng huyết áp, mệt mỏi hoặc suy nhược, tiêu chảy và đau bụng.
Bảng 14 liệt kê tất cả những phản ứng có hại của thuốc do sử dụng Avastin phối hợp với những phác đồ hóa trị khác nhau trong nhiều chỉ định. Những phản ứng này đã xảy ra, hoặc là với ít nhất 2% độ khác biệt so với nhóm chứng (phản ứng mức độ 3-5 theo NCI-CTC [Viện ung thư Quốc Gia-Tiêu chí độc tính thường gặp], hoặc là với ít nhất 10% độ khác biệt so với nhóm chứng (phản ứng mức độ 1-5 theo NCI-CTC), và chúng đã xảy ra ít nhất là ở một trong số các thử nghiệm lâm sàng chủ chốt. Những phản ứng có hại của thuốc được liệt kê trong bảng này nằm trong hai mức sau: Rất hay gặp (≥ 10%) và Hay gặp (≥ 1%-< 10%). Những phản ứng có hại của thuốc cũng đã được phân vào những nhóm phù hợp trong bảng dưới, theo tỷ lệ cao nhất mà chúng được quan sát thấy trong bất kỳ thử nghiệm lâm sàng chủ chốt nào. Trong mỗi nhóm theo tần suất xuất hiện này, những phản ứng có hại của thuốc được trình bày theo thứ tự giảm dần về mức độ nghiêm trọng. Một số những phản ứng có hại là những phản ứng thường được quan sát thấy khi dùng hóa trị (ví dụ như hội chứng loạn cảm giác đỏ lòng bàn tay-bàn chân do capecitabine, và bệnh lý thần kinh cảm giác ngoại biên do paclitaxel hoặc oxaliplatin); tuy nhiên, cũng không loại trừ được khả năng điều trị Avastin đã làm nặng hơn những phản ứng này.
Nguy cơ của hội chứng bàn tay bàn chân có thể trầm trọng hơn khi sử dụng Avastin phối hợp với doxorubicin dạng liposome có gắn gốc peg.
Thông tin thêm về những phản ứng có hại nghiêm trọng và có chọn lọc của thuốc: Những phản ứng ngoại ý dưới đây, được đánh giá độc tính theo NCI-CTC (tiêu chuẩn độc tính thường gặp), đã được ghi nhận ở những bệnh nhân được điều trị với Avastin:
Thủng đường tiêu hóa (xem phần Cảnh báo): Nhiều trường hợp thủng đường tiêu hóa nghiêm trọng đã xảy ra do Avastin. Những trường hợp thủng đường tiêu hóa đã được báo cáo trong các thử nghiệm lâm sàng với tỷ lệ dưới 1% trên những bệnh nhân bị ung thư vú di căn hoặc ung thư phổi không phải tế bào nhỏ, không vảy; và lên đến 2% trên những bệnh nhân bị ung thư tế bào thận di căn, u nguyên bào đệm thần kinh vừa mới chẩn đoán, hoặc ung thư buồng trứng đã được điều trị bước 1, và có thể lên đến 2,7% (bao gồm rò và áp xe đường tiêu hóa) ở những bệnh nhân ung thư đại trực tràng di căn. Cũng đã thấy có trường hợp bị thủng đường tiêu hóa trên bệnh nhân u nguyên bào thần kinh đệm tái phát.
Tử vong đã được báo cáo là khoảng một phần ba các trường hợp thủng đường tiêu hóa nghiêm trọng, tức khoảng từ 0,2% đến 1% tổng số bệnh nhân điều trị Avastin.
Những biến cố này có biểu hiện khác nhau về hình thức và độ nặng, thay đổi từ hơi tự do thấy trên phim X-quang bụng không cản quang, tự hồi phục không cần điều trị; cho đến thủng ruột với áp-xe ổ bụng và tử vong. Trong một vài trường hợp, đã có sẵn tình trạng viêm bên trong ổ bụng, hoặc là do bệnh loét dạ dày, hoại tử khối u, viêm túi thừa hoặc viêm đại tràng do hóa trị. Mối liên hệ nhân quả giữa tiến trình viêm bên trong ổ bụng và thủng đường tiêu hóa do Avastin vẫn chưa được xác lập.
Đường rò (xem phần Cảnh báo): Sử dụng Avastin liên quan đến các trường hợp rò nghiêm trọng, một số dẫn đến tử vong.
Trong các thử nghiệm lâm sàng của Avastin, rò đường tiêu hóa đã được báo cáo với tỷ lệ lên đến 2% ở những bệnh nhân ung thư đại trực tràng di căn và ung thư buồng trứng, nhưng cũng được báo cáo ít phổ biến hơn ở những bệnh nhân với các loại ung thư khác. Một số ít báo cáo (≥0,1% và <1%) là về các loại rò khác ở những cơ quan ngoài đường tiêu hóa (như rò phế quản màng phổi, rò đường niệu dục, rò đường mật) trong nhiều chỉ định khác nhau. Biến chứng rò cũng đã được báo cáo sau khi thuốc lưu hành trên thị trường.
Các biến cố này đã được báo cáo tại những thời điểm khác nhau trong suốt quá trình điều trị, từ 1 tuần cho đến hơn một năm kể từ lúc bắt đầu dùng Avastin, mà phần lớn là xảy ra trong vòng 6 tháng đầu của điều trị.
Xuất huyết: Trong những thử nghiệm lâm sàng ở mọi chỉ định, tỷ lệ toàn bộ những biến cố chảy máu độ 3-5 theo NCI-CTC là từ 0,4% đến 6,5% trên những bệnh nhân được điều trị với Avastin, so với tỷ lệ từ 0 đến 2,9% trên những bệnh nhân trong nhóm chứng chỉ dùng hóa trị. Các biến cố xuất huyết ghi nhận được trong các nghiên cứu lâm sàng về Avastin phần lớn là xuất huyết liên quan đến khối u (xem bên dưới) và xuất huyết da niêm mạc nhẹ (ví dụ chảy máu cam).
Xuất huyết liên quan đến khối u: Xuất huyết phổi/ho ra máu nặng hoặc ồ ạt đã được ghi nhận chủ yếu trong những nghiên cứu ở những bệnh nhân bị ung thư phổi không tế bào nhỏ (UTPKTBN). Những yếu tố nguy cơ bao gồm: có tế bào vảy trên mô học, được điều trị với thuốc chữa thấp khớp/kháng viêm, được điều trị với thuốc kháng đông, được xạ trị trước đó, được dùng Avastin, có tiền sử bị xơ vữa động mạch, khối u nằm ở trung tâm và khối u tạo hang trước hoặc trong khi điều trị. Chỉ có hai biến số cho thấy có mối tương quan có ý nghĩa về mặt thống kê đến sự chảy máu là: liệu pháp Avastin và tế bào vảy trên mô học. Những bệnh nhân bị UTPKTBN mà đã được biết là có tế bào vảy trên mô học hoặc có nhiều loại tế bào khác nhau nhưng tế bào vảy chiếm ưu thế trên mô học đã bị loại ra trong những nghiên cứu về sau; trong khi những bệnh nhân với mô học của khối u chưa được biết vẫn được thu nhận.
Ngoại trừ những trường hợp có tế bào vảy chiếm ưu thế trên mô học, ở những bệnh nhân bị UTPKTBN, các biến cố ở mọi mức độ đã được quan sát thấy với tỷ lệ lên đến 9% khi được điều trị với Avastin phối hợp hóa trị, trong khi tỷ lệ này là 5% ở những bệnh nhân chỉ dùng hóa trị đơn thuần. Những biến cố độ 3-5 đã được ghi nhận ở 2,3% số bệnh nhân được điều trị với Avastin phối hợp hóa trị, so với < 1% số bệnh nhân chỉ dùng hóa trị đơn thuần. Xuất huyết phổi/ho ra máu mức độ nặng hoặc ồ ạt có thể xảy ra đột ngột và có đến 2/3 những trường hợp xuất huyết phổi nặng đã bị tử vong (xem phần Cảnh báo).
Xuất huyết đường tiêu hóa, kể cả chảy máu trực tràng và tiêu phân đen đã được báo cáo ở những bệnh nhân ung thư đại trực tràng, và đã được đánh giá là xuất huyết liên quan đến khối u.
Xuất huyết liên quan khối u cũng đã xảy ra trên những loại khối u khác và trên khối u ở những vị trí khác, dù rất hiếm gặp, trong đó có một trường hợp chảy máu hệ thần kinh trung ương (TKTƯ) trên bệnh nhân u nguyên bào thần kinh đệm có di căn đến hệ thần kinh trung ương.
Tỷ lệ chảy máu TKTƯ trên bệnh nhân di căn TKTƯ không được điều trị và có dùng bevacizumab cũng chưa được đánh giá một cách tiền cứu trong các nghiên cứu lâm sàng ngẫu nhiên. Trong một phân tích thăm dò hồi cứu dựa trên số liệu của 13 thử nghiệm lâm sàng trên các bệnh nhân có các loại khối u khác nhau, trong số bệnh nhân điều trị với bevacizumab có 3 bệnh nhân trong số 91 (3,3%) có di căn tới não có biểu hiện chảy máu TKTƯ (tất cả đều ở mức độ 4), so với 1 bệnh nhân (mức độ 5) trong 96 bệnh nhân (1%) trong nhóm không sử dụng bevacizumab. Trong hai nghiên cứu đang tiến hành điều trị trên các bệnh nhân có di căn não, tính tới thời điểm phân tích an toàn sơ bộ, có 1 trường hợp chảy máu TKTƯ mức độ 2 trên 83 đối tượng điều trị với bevacizumab (1,2%).
Chảy máu nội sọ có thể gặp trên các bệnh nhân u nguyên bào thần kinh đệm tái phát. Trong nghiên cứu AVF3708g, chảy máu TKTƯ (mức độ 1) đã xuất hiện trên 2,4% (2/84) bệnh nhân trong nhóm đơn trị Avastin và 3,8% (3/97) trong nhóm điều trị kết hợp Avastin và irinotecan (ở các mức độ 1,2 và 4).
Qua tất cả các thử nghiệm lâm sàng, có đến 50% bệnh nhân được điều trị với Avastin bị chảy máu da niêm mạc. Thường gặp nhất là chảy máu cam độ I theo NCI-CTC, kéo dài dưới 5 phút, tự khỏi không cần can thiệp y tế và không đòi hỏi phải thay đổi phác đồ điều trị Avastin. Những dữ liệu an toàn trên lâm sàng gợi ý rằng tỷ lệ bị chảy máu niêm mạc nhẹ (như chảy máu cam) có thể tùy thuộc vào liều dùng.
Cũng có những biến cố xuất huyết niêm mạc nhẹ ở những vị trí khác, tuy ít gặp hơn, như chảy máu nướu răng và chảy máu âm đạo.
Tăng huyết áp (xem phần Cảnh báo): Tỷ lệ tăng huyết áp (với mọi mức độ) lên đến 42,1% ở những bệnh nhân được điều trị với Avastin, trong khi tỷ lệ này là 14% ở những bệnh nhân thuộc nhóm chứng. Trong những thử nghiệm lâm sàng cho tất cả các chỉ định, tỷ lệ toàn bộ các trường hợp tăng huyết áp độ 3-4 theo NCI-CTC ở những bệnh nhân dùng Avastin nằm trong khoảng từ 0,4% đến 17,9%. Tăng huyết áp độ 4 (cơn kịch phát tăng huyết áp) xảy ra ở 1,0% bệnh nhân dùng Avastin, trong khi chỉ xảy ra ở 0,2% bệnh nhân được dùng đơn thuần cùng loại hóa trị.
Tăng huyết áp nói chung có thể được kiểm soát thỏa đáng bằng các thuốc chống tăng huyết áp dùng đường uống như thuốc ức chế men chuyển angiotensin, thuốc lợi tiểu và thuốc chẹn kênh can-xi. Bệnh nhân hiếm khi phải ngừng điều trị Avastin hoặc phải nhập viện vì tăng huyết áp.
Rất hiếm trường hợp bệnh lý não do tăng huyết áp được báo cáo, vài trường hợp trong số này đã bị tử vong (xem thêm phần Cảnh báo). Nguy cơ tăng huyết áp khi sử dụng Avastin không tương quan với các đặc điểm ban đầu của bệnh nhân, bệnh đi kèm hoặc thuốc điều trị phối hợp.
Hội chứng chất trắng não sau có thể phục hồi (xem phần Cảnh báo): Hai trường hợp (0,8%) bị hội chứng chất trắng não sau có thể phục hồi đã được báo cáo trong một nghiên cứu lâm sàng. Những triệu chứng thường phục hồi hoặc cải thiện trong vài ngày, mặc dù một số bệnh nhân bị các di chứng thần kinh.
Thuyên tắc huyết khối
Thuyên tắc huyết khối động mạch: Trên những bệnh nhân được điều trị với Avastin ở tất cả các chỉ định, đã ghi nhận tăng tỉ lệ biến cố thuyên tắc huyết khối động mạch, bao gồm tai biến mạch máu não, nhồi máu cơ tim, cơn thoáng thiếu máu não, và các biến cố thuyên tắc huyết khối động mạch khác.
Trong các thử nghiệm lâm sàng, tỷ lệ toàn bộ đã lên đến 5,9% trong nhóm dùng Avastin so với 1,7% trong nhóm chứng dùng hóa trị. Đã có 0,8% bệnh nhân dùng Avastin phối hợp hóa trị liệu bị tử vong và tỷ lệ này ở những bệnh nhân chỉ dùng hóa trị đơn thuần là 0,5%. Tai biến mạch máu não (kể cả cơn thoáng thiếu máu não) đã xảy ra tới 2,3% số bệnh nhân được điều trị Avastin so với 0,5% số bệnh nhân trong nhóm chứng. Nhồi máu cơ tim đã xảy ra ở 1,4% số bệnh nhân được điều trị Avastin so với 0,7% số bệnh nhân trong nhóm chứng.
Trong thử nghiệm lâm sàng AVF2192g, những bệnh nhân bị ung thư đại trực tràng di căn mà không được điều trị với irinotecan đã được đưa vào nghiên cứu. Trong thử nghiệm này, những biến cố thuyên tắc huyết khối động mạch đã được quan sát thấy ở 11% (11/100) số bệnh nhân được điều trị Avastin, so với 5,8% (6/104) số bệnh nhân trong nhóm chứng sử dụng hóa trị.
Trong một thử nghiệm lâm sàng không đối chứng, AVF3708g, những bệnh nhân bị u nguyên bào đệm thần kinh tái phát, các biến cố huyết khối thuyên tắc động mạch được ghi nhận là 6,3% (5/79) ở những bệnh nhân điều trị Avastin phối hợp với irinotecan so với 4,8% (4/84) ở những bệnh nhân dùng Avastin đơn trị.
Thuyên tắc huyết khối tĩnh mạch: Trong những thử nghiệm lâm sàng cho mọi chỉ định, tỷ lệ toàn bộ các biến cố thuyên tắc huyết khối tĩnh mạch nằm trong khoảng từ 2,8% đến 17,3% trong nhóm bệnh nhân dùng Avastin, so với từ 3,2% đến 15,6% trong nhóm chứng dùng hóa trị. Các biến cố thuyên tắc huyết khối tĩnh mạch bao gồm huyết khối tĩnh mạch sâu và thuyên tắc phổi.
Các biến cố huyết khối thuyên tắc tĩnh mạch mức độ 3-5 đã được báo cáo lên đến 7,8% ở những bệnh nhân điều trị hóa trị kết hợp bevacizumab so với 4,9% ở những bệnh nhân chỉ điều trị hóa trị đơn thuần. Những bệnh nhân đã bị biến cố huyết khối thuyên tắc tĩnh mạch có thể có nguy cơ tái phát cao hơn nếu điều trị Avastin phối hợp hóa trị so với hóa trị đơn thuần.
Trong thử nghiệm lâm sàng BO21990, các biến cố huyết khối thuyên tắc tĩnh mạch mức độ 3-5 đã được báo cáo trong 7,6% các trường hợp được điều trị Avastin phối hợp với hóa xạ trị, so với 8,0% các trường hợp được điều trị hóa trị và xạ trị đơn thuần ở bệnh nhân mới được chuẩn đoán u nguyên bào thần kinh đệm.
Suy tim sung huyết: Trong những thử nghiệm lâm sàng với Avastin, suy tim sung huyết đã được quan sát thấy ở tất cả các chỉ định điều trị ung thư được nghiên cứu cho đến hiện nay, nhưng phần lớn là xảy ra ở những bệnh nhân bị ung thư vú di căn.
Trong 5 nghiên cứu pha III (AVF2119g, E2100, BO17708, AVF3694g và AVF3693g) trên bệnh nhân ung thư vú di căn, suy tim sung huyết độ 3 hoặc hơn đã được báo cáo lên tới 3,5% ở nhóm bệnh nhân điều trị Avastin phối hợp với hóa trị so với 0,9% ở nhóm chứng. Ở những bệnh nhân trong nghiên cứu AVF3694g được điều trị anthracyclines phối hợp đồng thời với bevacizumab, tỷ lệ suy tim sung huyết độ 3 hoặc hơn ở nhóm bevacizumab và nhóm chứng là tương đương với các nghiên cứu khác trên bệnh nhân ung thư vú di căn: 2,9% ở nhóm sử dụng anthracyclines phối hợp với bevacizumab và 0% ở nhóm sử dụng anthracyclines kết hợp với giả dược. Hơn thế, trong nghiên cứu AVF3694g, tỉ lệ suy tim sung huyết ở tất cả các mức độ là tương đương nhau giữa nhóm anthracyclines phối hợp Avastin (6,2%) và nhóm anthracycline phối hợp giả dược (6,0%).
Hầu hết những bệnh nhân bị suy tim sung huyết trong các thử nghiệm về ung thư vú di căn đã cải thiện các triệu chứng và/hoặc chức năng thất trái sau khi được điều trị thích hợp.
Trong hầu hết các thử nghiệm lâm sàng với Avastin, không có thông tin về nguy cơ bị suy tim sung huyết ở những bệnh nhân đang bị suy tim sung huyết độ II-IV theo NYHA, vì những bệnh nhân này đã bị loại khỏi các thử nghiệm lâm sàng.
Việc điều trị với anthracycline và/hoặc xạ trị vào thành ngực trước đó có thể là những yếu tố nguy cơ dẫn đến suy tim sung huyết (Xem phần Cảnh báo).
Xuất độ suy tim sung huyết tăng cao được ghi nhận trong một thử nghiệm lâm sàng ở những bệnh nhân bị lymphoma tế bào B lớn lan tỏa khi được điều trị bevacizumab phối hợp với doxorubicin với liều tích lũy lớn hơn 300mg/m2.
Nghiên cứu lâm sàng pha III này so sánh phác đồ rituximab/cyclophosphamide/doxorubicin/vincristine/prednisone (R-CHOP) kết hợp bevacizumab với phác đồ R-CHOP đơn thuần. Trong khi tỉ lệ suy tim sung huyết ở cả 2 nhóm đều cao hơn so với những gì đã được quan sát thấy trong liệu pháp doxorubicin trước đây, tỉ lệ suy tim sung huyết ở nhóm R-CHOP kết hợp với bevacizumab cao hơn.
Quá trình lành vết thương (xem phần Cảnh báo): Vì Avastin có thể tác động bất lợi lên quá trình lành vết thương, những bệnh nhân vừa qua đại phẫu trong vòng 28 ngày trước khi bắt đầu điều trị Avastin đã bị loại không được tham gia vào những thử nghiệm pha III.
Trong tất cả những thử nghiệm lâm sàng về ung thư đại trực tràng di căn, không ghi nhận tăng nguy cơ bị chảy máu hậu phẫu hoặc bị những biến chứng trong quá trình lành vết thương trên những bệnh nhân vừa được đại phẫu trong vòng từ 28 đến 60 ngày trước khi bắt đầu dùng Avastin. Đã ghi nhận được sự tăng tỷ lệ bị chảy máu hậu phẫu hoặc bị những biến chứng trong quá trình lành vết thương xảy ra trong vòng 60 ngày sau khi đại phẫu, nếu đến khi phẫu thuật bệnh nhân vẫn được điều trị với Avastin. Tỷ lệ này biến thiên từ 10% (4/40) đến 20% (3/15).
Các trường hợp biến chứng nặng trong quá trình lành vết thương đã được báo cáo trong khi sử dụng Avastin, trong đó một số đã tử vong (xem phần Cảnh báo).
Trong ung thư vú di căn và tái phát tại chỗ, những biến chứng trong quá trình lành vết thương độ 3-5 đã xảy ra ở 1,1% số bệnh nhân được điều trị với Avastin so với 0,9% ở nhóm chứng. Trong nghiên cứu trên bệnh nhân u tế bào thần kinh đệm tái phát (nghiên cứu AVF3708g) tỷ lệ bị biến chứng lành vết thương sau phẫu thuật là 3,6% (hở vết mở sọ hoặc rò dịch não tủy) trong nhóm bệnh nhân sử dụng Avastin đơn thuần và 1,3% trong nhóm kết hợp Avastin với irinotecan.
Ở những bệnh nhân vừa được chẩn đoán u nguyên bào đệm thần kinh (nghiên cứu BO21990), tỷ lệ các biến chứng trong quá trình lành vết thương hậu phẫu mức độ 3-5 (bao gồm các biến chứng sau mở hộp sọ) là 3,3% khi điều trị Avastin phối hợp với hóa trị và xạ trị, so với 1,6% khi điều trị hóa trị và xạ trị đơn thuần.
Đạm niệu (xem phần Cảnh báo): Trong những thử nghiệm lâm sàng, đạm niệu đã được báo cáo trong khoảng từ 0,7% đến 38% bệnh nhân được điều trị Avastin. Về mức độ trầm trọng, đạm niệu có thể thay đổi từ không có triệu chứng lâm sàng, thoáng qua, đạm niệu dạng vết cho đến hội chứng thận hư. Đạm niệu độ 3 được ghi nhận lên đến 8,1% ở bệnh nhân được điều trị. Đạm niệu độ 4 (hội chứng thận hư) đã được quan sát thấy ở 1,4% bệnh nhân được điều trị. Trong các thử nghiệm lâm sàng về Avastin, đạm niệu không kèm theo rối loạn chức năng thận và hiếm khi cần phải ngừng điều trị Avastin.
Bệnh nhân có tiền sử tăng huyết áp có thể tăng nguy cơ đạm niệu khi điều trị với Avastin. Có bằng chứng gợi ý đạm niệu độ 1 có thể liên quan với liều lượng Avastin. Nên tiến hành xét nghiệm phát hiện đạm niệu trước khi bắt đầu điều trị Avastin. Trong hầu hết các thử nghiệm lâm sàng, mức đạm niệu ≥ 2g/24giờ dẫn đến việc tạm ngưng Avastin cho đến khi hồi phục về mức < 2g/24 giờ.
Quá mẫn cảm, các phản ứng khi truyền (xem phần Cảnh báo và phần Tác dụng ngoại ý - Sau khi lưu hành trên thị trường): Trong một số thử nghiệm lâm sàng, các phản ứng phản vệ và dạng phản vệ đã được báo cáo là thường xảy ra hơn ở những bệnh nhân điều trị Avastin phối hợp với hóa trị hơn so với hóa trị đơn thuần. Tỉ lệ của các phản ứng trên trong một số thử nghiệm của Avastin là phổ biến (lên đến 5% ở những bệnh nhân được điều trị bevacizumab).
Suy giảm chức năng buồng trứng/Sinh sản (xem phần Cảnh báo và Sử dụng ở những đối tượng đặc biệt, phụ nữ có thai): Tần suất của các trường hợp mới bị suy giảm chức năng buồng trứng, được xác định bằng vô kinh kéo dài 3 tháng hoặc hơn, FSH ≥ 30 mIU/mL và xét nghiệm huyết thanh β-HCG âm tính, đã được đánh giá. Những trường hợp mới bị suy giảm chức năng buồng trứng được báo cáo là thường gặp hơn ở những bệnh nhân điều trị với bevacizumab. Sau khi ngưng điều trị bevacizumab, chức năng buồng trứng phục hồi ở phần lớn phụ nữ. Ảnh hưởng lâu dài của điều trị bevacizumab lên chức năng sinh sản chưa được biết rõ.
Nhiễm trùng (xem phần Cảnh báo): Trong thử nghiệm lâm sàng BO21990, một nghiên cứu đa trung tâm pha III, có đối chứng giả dược, mù đôi, ngẫu nhiên về điều trị Avastin phối hợp với hóa xạ trị cho những bệnh nhân vừa được chẩn đoán u nguyên bào đệm thần kinh, tỉ lệ nhiễm trùng ở tất cả các mức độ và mức độ 3-5 tương ứng là 54,4% và 12,8% đối với nhóm bệnh nhân điều trị bevacizumab kết hợp hóa xạ trị, so với nhóm bệnh nhân chỉ điều trị hóa xạ trị thì tỉ lệ theo thứ tự là 39,1% và 7,8%.
Người già: Trong những thử nghiệm lâm sàng ngẫu nhiên, những bệnh nhân ở độ tuổi > 65 thường tăng nguy cơ bị các biến cố thuyên tắc huyết khối động mạch bao gồm tai biến mạch máu não, cơn thoáng thiếu máu não và nhồi máu cơ tim so với những bệnh nhân ở độ tuổi ≤ 65 được điều trị với Avastin (xem phần Cảnh báo và Tác dụng ngoại ý - Kinh nghiệm từ các thử nghiệm lâm sàng, phần Thuyên tắc huyết khối). Các phản ứng khác với tần suất cao hơn ở những bệnh nhân trên 65 tuổi là giảm bạch cầu và giảm tiểu cầu độ 3-4; giảm bạch cầu trung tính ở mọi mức độ, tiêu chảy, buồn nôn, nhức đầu và mệt mỏi.
Không thấy có sự gia tăng tỉ lệ các phản ứng khác bao gồm thủng đường tiêu hóa, các biến chứng lành vết thương, tăng huyết áp, đạm niệu, suy tim sung huyết và xuất huyết trên bệnh nhân cao tuổi (> 65 tuổi) sử dụng Avastin so với những bệnh nhân ở độ tuổi ≤ 65 được điều trị với Avastin.
Các bất thường trên xét nghiệm: Giảm bạch cầu trung tính, giảm số lượng bạch cầu và đạm niệu có thể liên quan đến việc điều trị với Avastin.
Trong các thử nghiệm lâm sàng, các bất thường về xét nghiệm độ 3 và 4 được ghi nhận có tỷ lệ tăng (≥ 2%) trên bệnh nhân được điều trị Avastin so với bệnh nhân trong nhóm chứng là: tăng glucose huyết, giảm hemoglobin, giảm kali huyết, giảm natri huyết, giảm số lượng bạch cầu, tăng thời gian prothrombin (PT), tăng tỷ số chuẩn hóa quốc tế INR.
Bảo quản
Bảo quản lọ thuốc trong tủ lạnh ở nhiệt độ 2°C-8oC. Giữ nguyên lọ trong hộp bìa cứng vì thuốc nhạy cảm với ánh sáng.
KHÔNG ĐỂ ĐÔNG LẠNH. KHÔNG ĐƯỢC LẮC.
Avastin không chứa bất kỳ chất bảo quản chống vi khuẩn nào; vì vậy, phải cẩn thận để đảm bảo vô khuẩn cho dung dịch đã pha.
Độ ổn định của hóa tính và lý tính được chứng minh trong 48 giờ ở nhiệt độ 2°C-30oC trong dung dịch chloride natri 0,9%. Theo quan điểm vi sinh học, thuốc nên được sử dụng ngay lập tức. Nếu không sử dụng ngay, người sử dụng có trách nhiệm đảm bảo về thời gian và điều kiện bảo quản thuốc và thông thường không nên quá 24 giờ ở nhiệt độ 2°C-8oC, trừ khi việc pha thuốc được tiến hành trong điều kiện vô khuẩn được công nhận và có kiểm soát.
Trình bày/Đóng gói
Dung dịch đậm đặc pha dung dịch tiêm truyền: 25mg/ml x hộp 1 lọ 4ml, hộp 1 lọ 16ml.
Bài viết cùng chuyên mục
Axcel Dicyclomine-S Syrup: thuốc điều trị đau bụng đầy hơi
Axcel Dicyclomine-S Syrup là một amin bậc 3 với tác dụng kháng hệ muscarinic tương tự nhưng yếu hơn atropin. Axcel Dicyclomine-S Syrup làm giảm các cơn đau bụng, đầy hơi và chứng tức bụng do đầy hơi.
Acetazolamid
Acetazolamid là chất ức chế carbonic anhydrase. Ức chế enzym này làm giảm tạo thành ion hydrogen và bicarbonat từ carbon dioxyd và nước.
Aspirine PH8
Ở liều cao được chỉ định trong bệnh thấp khớp, cần theo dõi các dấu hiệu ù tai, giảm thính lực và chóng mặt. Nếu xảy ra các dấu hiệu này, cần giảm liều ngay.
Actifed
Actifed! Actifed và xirô Actifed phối hợp một chất đối kháng thụ thể H1 của histamine và một tác nhân làm giảm sung huyết ở mũi.
Aminoleban Oral: thuốc bổ sung dinh dưỡng giàu acid amin
Aminoleban Oral bổ sung dinh dưỡng giàu acid amin phân nhánh cần thiết khoảng 50°C được 200mL dung dịch cung cấp năng lượng 1kCal/mL.cho bệnh nhân suy gan. 1 gói x 3 lần/ngày. Pha gói 50g trong 180mL nước ấm.
Aquaphil: sữa làm sạch mềm không gây kích ứng da
Aquaphil không chứa kiềm, không chứa paraben, với công thức đặc biệt ít tạo bọt. Aquaphil nhẹ nhàng làm sạch làn da, vừa giúp da mềm mại và giữ lại độ ẩm cần thiết. Aquaphil còn là loại sữa lý tưởng cho làn da em bé.
Mục lục các thuốc theo vần A
A - Gram - xem Amoxicilin, A - Hydrocort - xem Hydrocortison, A - Methapred - xem Methyl prednisolon, A.P.L, xem Chorionic gonadotropin - Các gonadotropin, A.T.P - xem Adenosin
Acuvail: thuốc kháng viêm không steroid
Ketorolac tromethamin là một thuốc kháng viêm không steroid, khi dùng toàn thân có tác dụng giảm đau, chống viêm và hạ sốt. Cơ chế tác dụng của thuốc được cho là do khả năng ức chế quá trình sinh tổng hợp prostaglandin.
Anaferon for children: thuốc phòng và điều trị các trường hợp nhiễm virut đường hô hấp cấp tính
Dự phòng và điều trị các trường hợp nhiễm virut đường hô hấp cấp tính. Phối hợp điều trị trong các trường hợp nhiễm herpes virut (chứng tăng bạch cầu đơn nhân nhiễm trùng, thủy đậu, herpes môi, herpes sinh dục).
Amoclavic và Amoclavic Forte
Amoclavic là kháng sinh diệt khuẩn phổ rộng bao gồm nhiều dòng vi khuẩn Gram dương và Gram âm sinh hay không sinh b-lactamase.
Alendronat: thuốc điều trị và dự phòng loãng xương
Alendronat điều trị và dự phòng loãng xương ở phụ nữ mãn kinh, điều trị loãng xương ở đàn ông. Trong điều trị loãng xương, alendronat làm tăng khối lượng xương và ngăn ngừa gãy xương, kể cả khớp háng, cổ tay và đốt sống (gãy do nén đốt sống).
Artichoke: thuốc điều trị bệnh gan mật
Artichoke (Atisô) được đề xuất sử dụng bao gồm để chán ăn, và các vấn đề về gan và túi mật. Atisô có thể có hiệu quả đối với chứng khó tiêu và lượng chất béo cao trong máu (tăng lipid máu).
Alteplase
Trong nhồi máu cơ tim cấp, điều trị bằng chất hoạt hóa plasminogen mô nhằm tăng tưới máu của động mạch vành, giảm được kích cỡ nhồi máu, giảm được nguy cơ suy tim sau nhồi máu và giảm tử vong.
Andriol Testocaps: thuốc điều trị thiểu năng tuyến sinh dục
Liệu pháp thay thế testosteron dùng trong thiểu năng sinh dục do thiếu các hormon sinh dục ở một số thể bệnh lý như: thiếu hụt gonadotropin hoặc thiếu hormon giải phóng hormon tạo hoàng thể, tổn thương trục tuyến yên-dưới đồi do khối u, chấn thương, hoặc bức xạ.
Aciclovir
Aciclovir là một chất tương tự nucleosid, có tác dụng chọn lọc trên tế bào nhiễm virus Herpes, để có tác dụng aciclovir phải được phosphoryl hóa.
Atracurium: thuốc điều trị giãn cơ khi phẫu thuật và thông khí xâm nhập
Atracurium là một loại thuốc kê đơn được sử dụng để điều trị giãn cơ xương khi phẫu thuật, đặt nội khí quản và thông khí cơ học. Atracurium có sẵn dưới các tên thương hiệu Tacrium.
Aberel
Các thể bệnh trứng cá, trừ trứng cá đỏ, dùng cho các trường hợp như trứng cá thường, hội chứng Favre, và Racouchot, các bệnh trứng cá nghề nghiệp.
Acenac
Thuốc không được dùng cho người đang bị hay nghi ngờ có loét tá tràng hoặc loét đường tiêu hóa, hoặc người có tiền sử loét tá tràng hoặc đường tiêu hóa tái phát.
Amantadine: thuốc ngăn ngừa và điều trị bệnh cúm
Amantadine có thể giúp làm cho các triệu chứng bớt nghiêm trọng hơn và rút ngắn thời gian để khỏi bệnh. Dùng amantadine nếu đã hoặc sẽ tiếp xúc với bệnh cúm có thể giúp ngăn ngừa bệnh cúm.
Arbaclofen: thuốc điều trị bệnh đa xơ cứng và tự kỷ
Arbaclofen là một loại thuốc được sử dụng để giảm tình trạng co cứng liên quan đến bệnh đa xơ cứn. Arbaclofen cũng đang được nghiên cứu để cải thiện chức năng ở những bệnh nhân mắc hội chứng fragile X và chứng rối loạn phổ tự kỷ.
Acetaminophen IV: thuốc điều trị đau và sốt đường tĩnh mạch
Acetaminophen IV là một loại thuốc kê đơn được sử dụng để điều trị đau và sốt. Acetaminophen IV có sẵn dưới các tên thương hiệu khác nhau như Ofirmev.
Aziphar: thuốc kháng sinh điều trị nhiễm khuẩn
Aziphar được chỉ định dùng trong các trường hợp nhiễm khuẩn do các vi khuẩn nhạy cảm với thuốc như: nhiễm khuẩn đường hô hấp dưới, nhiễm khuẩn đường hô hấp trên, nhiễm khuẩn da và mô mềm.
Actelsar HCT 40mg/12,5mg: thuốc điều trị tăng huyết áp
Actelsar HCT là một sự kết hợp của một thuốc đối kháng thụ thể angiotensin II, telmisartan, và thuốc lợi tiêu thiazid, hydrochlorothiazide. Sự kết hợp của những thành phần này có tác dụng hạ huyết áp hiệp đồng, làm giảm huyết áp tốt hơn mỗi thành phần.
Axid
Nizatidine đối kháng có cạnh tranh thuận nghịch với histamine ở receptor H2, nhất là tại các receptor H2 ở tế bào thành của dạ dày.
Abound
Cho ăn đường ống: không pha trong túi tiếp thức ăn bằng ống. 1 gói + 120 mL nước ở nhiệt độ phòng, khuấy đều bằng thìa dùng 1 lần, kiểm tra vị trí đặt ống, tráng ống cho ăn bằng 30 mL nước.
